题目内容
20.主族元素W、X、Y、Z的原子序数依次增大,W的原子最外层电子数是次外层电子数的3倍.X、Y和Z分属不同的周期,它们的原子序数之和是W原子序数的5倍.在由元素W、X、Y、Z组成的所有可能的二组分化合物中,由元素W与Y形成的化合物M的熔点最高.请回答下列问题:(1)W元素原子的L层电子排布式为2s22p4,W3分子的空间结构为V型;
(2)X单质与水发生主要反应的方程为2F2+2H2O═4HF+O2;
(3)化合物M的化学式为MgO,其晶体结构与NaCl相同,而熔点高于NaCl.M熔点较高的原因是MgO的晶格能大于NaCl的晶格能.将一定量的化合物ZX负载在M上可制得ZX/M催化剂,用于催化碳酸二甲酯与月桂醇酯交换合成碳酸二月桂酯.在碳酸二甲酯分子中,碳原子采用的杂化方式有sp2和sp3,O-C-O的键角约为120°;
(4)X、Y、Z可形成立方晶体结构的化合物,其晶胞中X占据所有棱的中心,Y位于顶角,Z处于体心位置,则该晶体的组成X:Y:Z=3:1:1;
(5)许多金属盐都可以发生焰色反应,其原因是灼烧时电子从基态到激发态,当从激发态回到基态时放出能量以光的形式放出,从而出现不同的颜色.
分析 主族元素W、X、Y、Z的原子序数依次增大,W的原子最外层电子数是次外层电子数的3倍,则W有3个电子层,最外层电子数为6,故W为氧元素;X,Y,Z分属不同的周期,且主族元素W、X、Y、Z的原子序数依次增大.X不可能为第三周期元素,若为第三周期,X、Y、Z的原子序数之和大于W原子序数的5倍,所以可以断定X也在第二周期,且原子序数比氧元素大,故X为F元素;故Y、Z的原子序数之和为8×5-9=31,平均原子序数为15.5,故Y处于第三周期,Z处于第四周期,Z的原子序数大于18,若Y为Na元素,则Z为Ca元素,若Y为Mg元素,则Z为K元素,X的原子序数再增大,不符合题意,由于元素W与Y形成的化合物M的熔点最高,故Y为Mg元素,Z为K元素.以及对应单质化合物的性质以及题目要求可解答该题.
解答 解:主族元素W、X、Y、Z的原子序数依次增大,W的原子最外层电子数是次外层电子数的3倍,则W有3个电子层,最外层电子数为6,故W为氧元素;X,Y,Z分属不同的周期,且主族元素W、X、Y、Z的原子序数依次增大.X不可能为第三周期元素,若为第三周期,X、Y、Z的原子序数之和大于W原子序数的5倍,所以可以断定X也在第二周期,且原子序数比氧元素大,故X为F元素;故Y、Z的原子序数之和为8×5-9=31,平均原子序数为15.5,故Y处于第三周期,Z处于第四周期,Z的原子序数大于18,若Y为Na元素,则Z为Ca元素,若Y为Mg元素,则Z为K元素,X的原子序数再增大,不符合题意,由于元素W与Y形成的化合物M的熔点最高,故Y为Mg元素,Z为K元素.
(1)W为氧元素,O原子的L层电子排布式为2s22p4;O3分子中中心氧原子价层电子对数=2+$\frac{6-2×2}{2}$=3、含有1对孤电子对,故O3空间构型为V型,
故答案为:2s22p4;V型;
(2)X为F元素,对应的单质具有强氧化性,可与水反应生成HF和氧气,反应的方程式为:2F2+2H2O═4HF+O2,
故答案为:2F2+2H2O═4HF+O2;
(3)由上述分析可知,M为MgO,其晶体结构与NaCl相同,而熔点高于NaCl,由于MgO晶体中离子的电荷多,晶格能大,故MgO熔点较高;
在碳酸二甲酯分子中-OCH3,C原子4个单键,采取sp3杂化,在酯基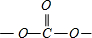 中,C原子呈2个C-O单键,属于σ键,1个C=O双键,双键按单键计算,故中心C原子的杂化轨道数为3,采取sp2杂化,为平面正三角形,键角为120°,故O-C-O的键角约为120°,
中,C原子呈2个C-O单键,属于σ键,1个C=O双键,双键按单键计算,故中心C原子的杂化轨道数为3,采取sp2杂化,为平面正三角形,键角为120°,故O-C-O的键角约为120°,
故答案为:MgO;MgO的晶格能大于NaCl的晶格能;sp2和sp3;120°;
(4)F、Mg、K形成立方晶体结构的化合物,晶胞中F占据所有棱的中心,晶胞中F原子数目为12×$\frac{1}{4}$=3,Mg位于顶角,晶胞中Mg原子数目为8×$\frac{1}{8}$=1,K处于体心位置,晶胞中含有1个K原子,则该晶体的组成为F:Mg:K=3:1:1,
故答案为:3:1:1.
(5)含有元素K的盐的焰色反应为紫色,许多金属盐都可以发生焰色反应,其原因为:灼烧时电子从基态到激发态,当从激发态回到基态时放出能量以光的形式放出,从而出现不同的颜色,
故答案为:灼烧时电子从基态到激发态,当从激发态回到基态时放出能量以光的形式放出,从而出现不同的颜色.
点评 本题考查位置、结构与性质关系的综合应用,题目难度中等,侧重于学生分析能力和综合运用元素周期表的和周期律的考查,为高考常见题型,推断元素是解题的关键,要充分利用原子序数的关系结合周期表的结构进行判断元素.

 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案| A. | CuO→Cu | B. | KCl→AgCl | C. | Fe→FeCl3 | D. | NaHCO3→CO2 |
 用铅蓄电池电解甲、乙电解池中的溶液.已知铅蓄电池的总反应为:
用铅蓄电池电解甲、乙电解池中的溶液.已知铅蓄电池的总反应为:Pb(s)+PbO2(s)+2H2SO4(aq)═2PbSO4(s)+2H2O(l),电解一段时间后向c极和d极附近分别滴加酚酞试剂,c极附近溶液变红,下列说法正确的是( )
| A. | d极为阴极 | |
| B. | 放电时铅蓄电池负极的电极反应式为:PbO2(s)+4H+(aq)+SO42-(aq)+4e-═PbSO4 (s)+2H2O (l) | |
| C. | 若利用甲池精炼铜,b极应为粗铜 | |
| D. | 若四个电极材料均为石墨,当析出6.4 g Cu时,两池中共产生气体3.36 L(标准状况下) |
| A. | 铜是正极,铜片上有气泡产生 | B. | 氢离子在锌片表面被还原 | ||
| C. | 电流从锌片经导线流向铜片 | D. | 铜片质量逐渐减少 |
 将甲烷与氯气按1:3的体积比混合于一试管中,倒立于盛有饱和食盐水的水槽,置于光亮处(如图所示),下列有关此实验的现象和结论的叙述不正确的是( )
将甲烷与氯气按1:3的体积比混合于一试管中,倒立于盛有饱和食盐水的水槽,置于光亮处(如图所示),下列有关此实验的现象和结论的叙述不正确的是( )| A. | 试管中气体的黄绿色逐渐变浅,水面上升 | |
| B. | 生成物只有三氯甲烷和氯化氢在标准状况下是气体 | |
| C. | 试管内壁有油状液滴形成 | |
| D. | 试管内有少量白雾 |
①苯不能使酸性KMn4溶液褪色 ②苯不能使溴水因化学反应而褪色 ③经实验测定,邻二甲苯只有一种结构
④苯能在加热和催化剂条件下氢化成环己烷 ⑤苯中相邻碳原子间的距离都相等.
| A. | 只有①② | B. | 只有④⑤ | C. | 只有①②⑤ | D. | 只有①②③⑤ |
| A. | 酯的水解,酯化反应,乙醇和氢卤酸反应,乙醇和浓硫酸在140℃时加热 | |
| B. | 苯硝化,苯和氢气反应,皂化反应 | |
| C. | 淀粉在硫酸存在下制葡萄糖,醛的氧化或还原 | |
| D. | 纤维素水解,浓硫酸和乙醇在170℃时的反应,蛋白质水解 |
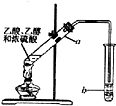 如图装置可用于实验室制取乙酸乙酯,请回答下列问题.
如图装置可用于实验室制取乙酸乙酯,请回答下列问题. CH3COOC2H5+H2O,反应类型是酯化反应(或取代反应);
CH3COOC2H5+H2O,反应类型是酯化反应(或取代反应);
 .
. CH3COOCH2CH3+H2O,反应类型酯化反应或取代反应.
CH3COOCH2CH3+H2O,反应类型酯化反应或取代反应.