题目内容
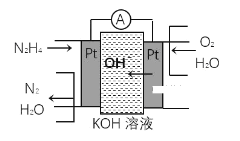
【题目】(1)肼(N2H4)又称联氨,广泛用于火箭推进剂、有机合成及燃料电池,肼燃料电池原理如图所示,通入N2H4的电极上发生的电极反应式为______。
(2)在2L密闭容器中,800 ℃时反应2NO(g)+O2(g)![]() 2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
①到达平衡时NO的转化率为____。
②用O2表示从0~2 s内该反应的平均速率v=_____。
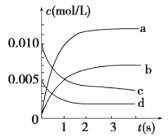
③如图所示,表示NO2变化曲线的是_____。
④能说明该反应已达到平衡状态的是_____(填序号)。
A.v(NO2)=2v(O2)
B.容器内压强保持不变
C.v逆(NO)=2v正(O2)
D.容器内的密度保持不变
【答案】N2H4—4e-+4OH-=N2+4H2O 65% 1.5×10-3 mol·L-1·s-1 b BC
【解析】
(1)燃料电池中通入燃料肼的为负极,负极发生氧化反应,结合图示书写电极反应式;
(2)①根据表格数据,求出反应的NO的物质的量,再计算NO的转化率;②先计算一氧化氮的反应速率,再根据同一化学反应中同一时间段内,各物质的反应速率之比等于其计量数之比计算氧气的反应速率;③根据表格知,随着反应的进行,一氧化氮的物质的量减小,则平衡向正反应方向移动,二氧化氮的物质的量逐渐增大,根据一氧化氮和二氧化氮之间转化关系式计算平衡时二氧化氮的物质的量,从而确定曲线;④根据化学平衡状态的判断依据判断。
(1)肼燃料电池中通入燃料肼的为负极,肼在碱性电解质中失去电子生成氮气和水,电极反应为N2H4-4e-+4OH-=N2+4H2O,故答案为:N2H4-4e-+4OH-=N2+4H2O;
(2)①根据表格数据,到达平衡时NO的转化率=![]() ×100%=65%,故答案为:65%;
×100%=65%,故答案为:65%;
②0~2s时,v(NO)=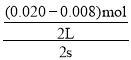 =0.003mol/(L·s),同一化学反应中同一时间段内,各物质的反应速率之比等于其计量数之比,所以v(O2)=
=0.003mol/(L·s),同一化学反应中同一时间段内,各物质的反应速率之比等于其计量数之比,所以v(O2)=![]() v(NO)=0.0015mol/(L·s),故答案为:0.0015mol/(L·s);
v(NO)=0.0015mol/(L·s),故答案为:0.0015mol/(L·s);
③根据表格数据知,随着反应的进行,一氧化氮的物质的量减小,则平衡向正反应方向移动,二氧化氮的物质的量逐渐增大,当反应达到平衡状态时,参加反应的n(NO)=(0.020-0.007)mol=0.013mol,根据二氧化氮和一氧化氮的关系式知,平衡状态时生成n(NO2)等于参加反应的n(NO),所以为0.013mol,c(NO2)=![]() =0.0065mol/L,所以代表二氧化氮的曲线为b,故答案为:b;
=0.0065mol/L,所以代表二氧化氮的曲线为b,故答案为:b;
④A.无论反应是否达到平衡状态,v(NO2)=2v(O2)始终存在,故A错误;B.该反应是气体体积变化的反应,所以该反应的压强为变量,压强不再变化,说明反应达平衡状态,故B正确;C.v正(NO)=2v逆(O2),正逆反应符合系数比,表示正逆反应速率相等,说明反应达平衡状态,故C正确;D.根据质量守恒,反应前后气体的质量不变,容器的体积不变,所以密度始终不变,不能说明达到平衡状态,故D错误;故选BC。

【题目】下列离子方程式的书写及评价均合理的是( )
选项 | 离子方程式 | 评价 |
A | 将2 mol Cl2通入含1 mol FeI2的溶液中: 2Fe2++2I-+2Cl2===2Fe3++4Cl-+I2 | 正确;Cl2过量,可将Fe2+、I-均氧化 |
B | Ba(HCO3)2溶液与足量的NaOH溶液反应: Ba2++HCO3-+OH-===BaCO3↓+H2O | 正确;酸式盐与碱反应生成正盐和水 |
C | 过量SO2通入NaClO溶液中: SO2+H2O+ClO-===HClO+HSO3- | 正确;说明酸性:H2SO3强于HClO |
D | 1 mol/L的NaAlO2溶液和2.5 mol/L的HCl溶液等体积混合: 2AlO2-+5H+===Al3++Al(OH)3↓+H2O | 正确;第一步反应和第二步反应消耗的H+的物质的量之比为2∶3 |
A. A B. B C. C D. D
【题目】已知X、Y、Z、W均为中学化学中常见的单质或化合物,它们之间的转化关系如图所示(部分产物已略去)。则W、X不可能是( )

选项 | W | X |
A | 稀硫酸 | NaAlO2溶液 |
B | 稀硝酸 | Fe |
C | CO2 | Ca(OH)2溶液 |
D | Cl2 | Fe |
A. A B. B C. C D. D