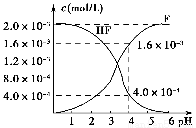
题目内容
(1)在100 ℃恒温条件下将0.100 mol的N2O4充入体积为1 L的真空密闭容器中,发生反应:N2O4(g) 2NO2(g) ΔH>0。隔一定时间对该容器内的物质进行分析,得到如下数据:
2NO2(g) ΔH>0。隔一定时间对该容器内的物质进行分析,得到如下数据:
t/s c/(mol·L-1) | 0 | 20 | 40 | 60 | 80 | 100 |
c(N2O4)/(mol·L-1) | 0.100 | a | 0.5b | 0.4b |
|
|
c(NO2)/(mol·L-1) | 0 | 0.060 | b | c1 | c2 | c3 |
请回答下列问题:
①表中a=________,在0~20 s内N2O4的平均反应速率为_______mol·(L·s)-1。
②已知100 ℃时该反应的平衡常数为0.36,则表中b、c1、c2的大小关系为________,c3=________mol·L-1,达到平衡时N2O4的转化率为________________________________。
(2)室温下,把SiO2细粉放入蒸馏水中,不断搅拌,能形成H4SiO4溶液,反应原理如下:
SiO2(s)+2H2O(l)??H4SiO4(aq) ΔH
①写出该反应的化学平衡常数K的表达式:____________________________。
②实际上,在地球的深处,由于压强很大,固体、液体都会受到影响。在一定温度下,在10 000 m以下的地球深处,上述反应的方向是________(填“正方向”、“逆方向”或“不移动”),理由是_______________________________。
(1)①0.070 1.5×10-3 ②b<c1=c2(或c1=c2>b) 0.120 60% (2)①K=c(H4SiO4) ②正方向 由于固体、液体都会受到大气压强的影响,故此时K的表达式应为K=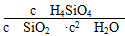 ,增大压强时,平衡向正反应方向移动
,增大压强时,平衡向正反应方向移动
【解析】 (1)根据表中数据和反应方程式可得(0.100-a)∶0.060=1∶2,解得a=0.070;由(0.100-0.5b)∶b=1∶2,解得b=0.100;由(0.100-0.4b)∶c1=1∶2,解得c1=0.120,此时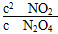 =0.36,即第60 s时反应已达平衡状态。
=0.36,即第60 s时反应已达平衡状态。
(2)①由于情境陌生,在书写化学平衡常数K的表达式时容易把水和二氧化硅写上。仔细审题会发现二氧化硅是固体,由于H4SiO4溶液的浓度很小,水的浓度可看成常数,故K=c(H4SiO4)。
②压强增大,分析平衡移动的方向,注意在压强很大的条件下,此时压强对固体、液体的影响不能忽略不计。

 捷径训练检测卷系列答案
捷径训练检测卷系列答案 小夫子全能检测系列答案
小夫子全能检测系列答案25 ℃时,5种银盐的溶度积常数(Ksp)分别是:
AgCl | Ag2SO4 | Ag2S | AgBr | AgI |
1.8×10-10 | 1.4×10-5 | 6.3×10-50 | 7.7×10-13 | 8.51×10-16 |
下列说法正确的是( )。
A.氯化银、溴化银和碘化银的溶解度依次增大
B.将硫酸银溶解于水后,向其中加入少量硫化钠溶液,不可能得到黑色沉淀
C.在5 mL 1.8×10-5 mol·L-1的NaCl溶液中,加入1滴(1 mL约20滴)0.1 mol·L-1的AgNO3溶液,不能观察到白色沉淀
D.将浅黄色溴化银固体浸泡在饱和氯化钠溶液中,可以有少量白色固体生成
900 ℃时,向2.0 L恒容密闭容器中充入0.40 mol乙苯,发生反应:
 ΔH=a kJ·mol-1。经一段时间后达到平衡。反应过程中测定的部分数据见下表:
ΔH=a kJ·mol-1。经一段时间后达到平衡。反应过程中测定的部分数据见下表:
时间/min | 0 | 10 | 20 | 30 | 40 |
n(乙苯)/mol | 0.40 | 0.30 | 0.24 | n2 | n3 |
n(苯乙烯)/mol | 0.00 | 0.10 | n1 | 0.20 | 0.20 |
下列说法正确的是( )。
A.反应在前20 min的平均速率为v(H2)=0.008 mol·L-1·min-1
B.保持其他条件不变,升高温度,平衡时,c(乙苯)=0.08 mol·L-1,则a<0
C.保持其他条件不变,向容器中充入不参与反应的水蒸气作为稀释剂,则乙苯的转化率为50.0%
D.相同温度下,起始时向容器中充入0.10 mol乙苯、0.10 mol苯乙烯和0.30 mol H2,达到平衡前v正>v逆