题目内容
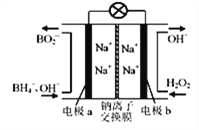
【题目】Mg-AgCl电池是一种以海水为电解质溶液的水激活电池。下列叙错误的是
A. 负极反应式为Mg-2e-=Mg2+
B. 正极反应式为Ag+e-=Ag
C. 电池放电时Cl-由正极向负极迁移
D. 电池放电时,外电路中,电子由负极向正极移动
【答案】B
【解析】A.活泼金属镁作负极,失电子发生氧化反应,反应式为:Mg-2e-=Mg2+,故A正确;B.AgCl是难溶物,其电极反应式为:2AgCl+2e-═2C1-+2Ag,故B错误;C.原电池放电时,阴离子向负极移动,则Cl-在正极产生由正极向负极迁移,故C正确;D.原电池工作时,外电路中电子由负极向正极移动,故D正确;故选B。

【题目】热化学和各类平衡等都是化学研究的对象
(1)已知:①2O2(g)+N2(g)==N2O4(l) △H1;
②N2(g)+2H2(g)==N2H4(g) △H2;
③O2(g)+2H2(g)==2H2O(g) △H3;
④2N2H4(g) +N2O4(1)==3N2(g)+4H2O(g) △H4。
上述反成热效应之间的关系式为△H4 =_______(用含△H1、△H2、△H3的代数式表示)。
(2)将不同量的H2O(g)和CO(g)分别通入体积为2L的恒容密闭容器中,进行反应:H2O(g)+CO(g) ![]() H2(g)+CO2(g),得到如下表三组数据:
H2(g)+CO2(g),得到如下表三组数据:
实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡 所需时间/min | ||
H2O | CO | H2 | CO | |||
1 | 800 | 2 | 4 | 4/3 | 8/3 | 6 |
2 | 900 | 1 | 2 | 0.4 | 1.6 | 3 |
3 | 900 | a | b | c | d | t |
①该反应的逆反应为______(填“吸热”或“放热”)反应;实验2的平衡常数K=________。
②若实验3达到平衡时与实验2达到平衡状态时各物质的体积分数分别相等,且t<3,则a、b应满足的关系是_______(用含a、b的代数式表示)。
③若保持温度和容积不变,向实验1再增加4molH2O(g),使反应达到新的平衡。下列说法不正确的是______(填序号)。
A.新、旧平衡时容器内气体的压强之比是5 : 3
B.新平衡时H2O的转化率增大
C.新平衡时CO的浓度是0.8 mol·L-l
D.新、旧平衡时容器内气体密度之比为5 : 3
(3)室温下,用0.1 mol·L-l的KOH溶液滴定10.00Ml0.10 mol·L-l H2C2O4 (二元弱酸)溶液,所得滴定曲线如图(混合溶液的体积可看成混合前溶液的体积之和)。请回答下列问题:
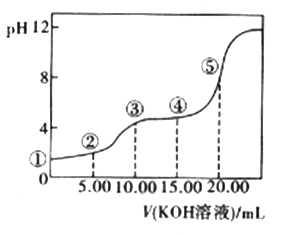
a.点②所示溶液中的电荷守恒式为________________________。
b.点③所示溶液中所有离子的浓度由大到小的顺序为___________________。
c.成④所示溶液中c(K+)+c(H2C2O4)+c(HC2O4-)+c(C2O42-)=________mol/L。