题目内容
将一定质量的硝酸铵,置于真空中,加热至300℃使其完全分解,分解方程式为:2NH4NO3=2N2+O2+4H2O,混合气体的平均摩尔质量为
A.22.9g/mol B.26  C.26 g/mol D.29.3 g/mol
C.26 g/mol D.29.3 g/mol
汽车尾气和燃煤造成空气污染。
(1)CO2是大气中含量最高的一种温室气体,控制和治理CO2是解决温室效应的有效途径.目前,由CO2来合成二甲醚已取得了较大的进展,其化学反应是:2CO2(g)+6H2(g) CH3OCH3(g)+3H2O(g)△H=+QkJ/mol
CH3OCH3(g)+3H2O(g)△H=+QkJ/mol
①反应的平衡常数和温度的关系如下:
温度/℃ | 700 | 800 | 830 | 1000 | 1200 |
平衡常数 | 0.4 | 0.6 | 1.0 | 1.1 | 1.7 |
写出该反应平衡常数表达式:K=__________。
向一个10L的密闭容器中充入10mol CO2和7molH2,830℃时测得H2为lmol,此时V (正)________V (逆):(选填“>”、“<”)
②判断该反应在一定温度下,体积恒定的密闭容器中达到化学平衡状态的依据是__________。
A. 容器中密度不变
B. 容器内压强保持不变
C.平均摩尔质量保持不变
D.v(CO2) :v(H2) =1:3
E.单位时间内消耗2 mol CO2,同时消耗1 mol二甲醚
F.△H不变
(2)汽车尾气净化的主要原理为2NO(g)+2CO(g) 2CO2(g)+N2(g)。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如图所示。
2CO2(g)+N2(g)。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如图所示。
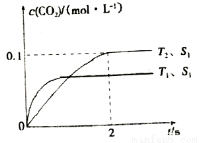
①在T2温度下,0~2 s内的平均反应速率v(N2)=__________;
②当固体催化剂的质量一定时,增大其表面积可提高化学反应速率。若催化剂的表面积S1〉S2,在上图中画出c(CO2)在T1、S2条件下达到平衡过程中的变化趋势曲线。
(3)工业上用CO和H2合成 CH3OH:CO (g) +2H2 (g)  CH3OH (g)
CH3OH (g)
①现在容积均为1 L的a、b、c三个密闭容器中分别充入1 mol CO和2 mol H2的混合气体,控制温度进行反应,测得相关数据的关系如图所示。下列说法正确的是____________

A.正反应的△H>0
B.反应进行到5 min时,b容器中v正=v逆
C.减压可使甲醇的含量由b点变成c点
D.达到平衡时,a、b、c中CO的转化率为b>a>c
②某温度下,在体积固定的4L密闭容器中将1molCO和2molH2混合,测得不同时刻的反应前后压强关系如下:
时间(min) | 5 | 10 | 15 | 20 | 25 | 30 |
压强比(p后/p前) | 0.98 | 0.90 | 0.80 | 0.70 | 0.70 | 0.70 |
达到平衡时CO的转化率为__________。
在一体积可变的密闭容器中,加入一定量的X、Y、Z,发生反 应mX(g)  nY(g)+pZ(s) △H = Q kJ/mol。反应达到平衡时,Y的物质的量浓度与温度、气体体积的关系如表所示:
nY(g)+pZ(s) △H = Q kJ/mol。反应达到平衡时,Y的物质的量浓度与温度、气体体积的关系如表所示:
下列说法正确的是( )
气体体积/L c(Y)/mol•L-1 温度/℃ | 1 | 2 | 3 |
100 | 1.00 | 0.75 | 0.53 |
200 | 1.20 | 0.90 | 0.63 |
300 | 1.30 | 1.00 | 0.70 |
A.m>n+p
B.Q<0
C.温度不变,压强增大,Y的体积分数减少
D.体积不变,温度升高,平衡向逆反应方向移动



 2-、HS-、NH4+
2-、HS-、NH4+