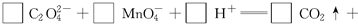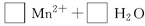题目内容
下列说法正确的是( )
A.ΔH<0、ΔS>0的反应在温度低时不能自发进行
B.NH4HCO3(s)=NH3(g)+H2O(g)+CO2(g) ΔH=+185.57 kJ·mol-1能自发进行,原因是体系有自发地向混乱度增加方向转变的倾向
C.因为焓变和熵变都与反应的自发性有关,因此焓变或熵变均可以单独作为反应自发性的判据
D.在其他外界条件不变的情况下,使用催化剂,可以改变化学反应进行的方向
B
【解析】ΔH<0、ΔS>0,则ΔG<0,任何温度下反应都能自发进行,A项错误,B项正确;用焓变和熵变判断反应的自发性都有例外,故都不能单独作为反应自发性的判据,而应用复合判据,C项错误;使用催化剂只能降低反应的活化能,不能改变反应的方向,D项错误。

练习册系列答案
相关题目