题目内容
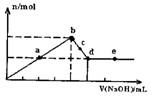
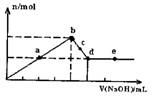
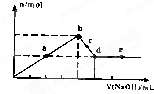
向MgC12和A1C13的混合溶液中加入氢氧化钠溶液,所得沉淀的物质的量(n)与加入氢氧化钠溶液的体积(V)关系如图所示.则下列说法正确的是( )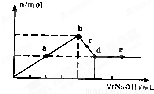
A.a、c两点沉淀物成份相同,d、e两点沉淀物成份相同
B.b点溶液的中c(Na+)=c(C1-)
C.b-c段与c-d段溶液中阴离子的物质的量相等
D.在d点,向溶液中加入少量盐酸,沉淀量将减少
【答案】分析:A、开始生成沉淀量到沉淀量最大,AlCl3和MgCl2的混合溶液与NaOH溶液,发生反应生成氢氧化铝、氢氧化镁沉淀,然后发生反应NaOH+Al(OH)3=NaAlO2+2H2O,氢氧化铝溶解,沉淀量不变时,氢氧化铝完全溶解,沉淀为氢氧化镁;
B、b点时沉淀量最大,AlCl3和MgCl2的混合溶液与NaOH溶液恰好反应,溶液中溶质为NaCl;
C、溶液中的阳离子为钠离子,阴离子为氯离子与偏铝酸根离子,都为1价离子,钠离子越多阴离子越多;
D、在d点沉淀量降低到最小,氢氧化铝完全溶解,沉淀为氢氧化镁,此时溶液为NaCl、NaAlO2溶液,滴加盐酸偏铝酸钠先反应.
解答:解:A、开始生成沉淀量到沉淀量最大,AlCl3和MgCl2的混合溶液与NaOH溶液,发生反应生成氢氧化铝、氢氧化镁沉淀,然后发生反应NaOH+Al(OH)3=NaAlO2+2H2O,a、c两点沉淀都是氢氧化铝与氢氧化镁,在d点沉淀量降低到最小,氢氧化铝完全溶解,沉淀为氢氧化镁,故d、e两点沉淀都是氢氧化镁,故A正确;
B、b点时沉淀量最大,AlCl3和MgCl2的混合溶液与NaOH溶液恰好反应,溶液中溶质为NaCl,由电荷守恒可知溶液的中c(Na+)=c(C1-),故B正确;
C、溶液中的阳离子为钠离子,阴离子为氯离子与偏铝酸根离子,都为1价离子,c-d段溶液中钠离子更多,故c-d段溶液中
阴离子多,故C错误;
D、在d点沉淀量降低到最小,氢氧化铝完全溶解,沉淀为氢氧化镁,此时溶液为NaCl、NaAlO2溶液,加入盐酸偏铝酸钠与盐酸反应生成氢氧化铝沉淀,沉淀量增大,故D错误;
故选AB.
点评:本题以图象题的形式考查镁铝化合物的性质,题目难度中等,清楚图象各阶段发生反应是解题关键,注意基础知识的掌握.
B、b点时沉淀量最大,AlCl3和MgCl2的混合溶液与NaOH溶液恰好反应,溶液中溶质为NaCl;
C、溶液中的阳离子为钠离子,阴离子为氯离子与偏铝酸根离子,都为1价离子,钠离子越多阴离子越多;
D、在d点沉淀量降低到最小,氢氧化铝完全溶解,沉淀为氢氧化镁,此时溶液为NaCl、NaAlO2溶液,滴加盐酸偏铝酸钠先反应.
解答:解:A、开始生成沉淀量到沉淀量最大,AlCl3和MgCl2的混合溶液与NaOH溶液,发生反应生成氢氧化铝、氢氧化镁沉淀,然后发生反应NaOH+Al(OH)3=NaAlO2+2H2O,a、c两点沉淀都是氢氧化铝与氢氧化镁,在d点沉淀量降低到最小,氢氧化铝完全溶解,沉淀为氢氧化镁,故d、e两点沉淀都是氢氧化镁,故A正确;
B、b点时沉淀量最大,AlCl3和MgCl2的混合溶液与NaOH溶液恰好反应,溶液中溶质为NaCl,由电荷守恒可知溶液的中c(Na+)=c(C1-),故B正确;
C、溶液中的阳离子为钠离子,阴离子为氯离子与偏铝酸根离子,都为1价离子,c-d段溶液中钠离子更多,故c-d段溶液中
阴离子多,故C错误;
D、在d点沉淀量降低到最小,氢氧化铝完全溶解,沉淀为氢氧化镁,此时溶液为NaCl、NaAlO2溶液,加入盐酸偏铝酸钠与盐酸反应生成氢氧化铝沉淀,沉淀量增大,故D错误;
故选AB.
点评:本题以图象题的形式考查镁铝化合物的性质,题目难度中等,清楚图象各阶段发生反应是解题关键,注意基础知识的掌握.

练习册系列答案
 金钥匙试卷系列答案
金钥匙试卷系列答案
相关题目
向MgC12和A1C13的混合溶液中加入氢氧化钠溶液,所得沉淀的物质的量(n)与加
入氢氧化钠溶液的体积(V)关系如右图所示。则下列说法正确的是( )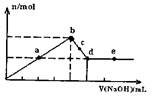
| A.a、c两点沉淀物成份相同,d、e两点沉淀物成份相同 |
| B.b点溶液的中c(Na+)=c(C1—) |
| C.b-c段与c-d段溶液中阴离子的物质的量相等 |
| D.在d点,向溶液中加入少量盐酸,沉淀量将减少 |
 向MgC12和A1C13的混合溶液中加入氢氧化钠溶液,所得沉淀的物质的量(n)与加入氢氧化钠溶液的体积(V)关系如图所示.则下列说法正确的是( )
向MgC12和A1C13的混合溶液中加入氢氧化钠溶液,所得沉淀的物质的量(n)与加入氢氧化钠溶液的体积(V)关系如图所示.则下列说法正确的是( )