题目内容
晶体硅是一种重要的非金属材料,制备纯硅的主要步骤如下:
①高温下用碳还原二氧化硅制得粗硅;
②粗硅与干燥HCl气体反应制得SiHCl3:Si+3HCl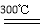 SiHCl3+H2;
SiHCl3+H2;
③SiHCl3与过量H2在1 000~1 100 ℃反应制得纯硅已知SiHCl3能与H2O强烈反应,在空气中易自燃。
请回答下列问题:
(1)第①步制备粗硅的化学方程式为_____________________________________________。
(2)粗硅与HCl反应完全后,经冷凝得到的SiHCl3(沸点33.0 ℃)中含有少量SiCl4(沸点57.6 ℃)和HCl(沸点-84.7 ℃),提纯SiHCl3采用的方法为___________________________。
(3)用SiHCl3与过量H2反应制备纯硅的装置如下(热源及夹持装置略去):
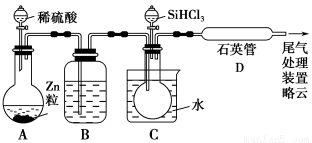
①装置B中的试剂是________。装置C中的烧瓶需要加热,其目的是________________________________________________________________。
②反应一段时间后,装置D中观察到的现象是________,装置D不能采用普通玻璃管的原因是____________,装置D中发生反应的化学方程式为_____________________________________________________________。
③为保证制备纯硅实验的成功,操作的关键是检查实验装置的气密性,控制好反应温度以及___________________________________________________________。
(1)SiO2+2C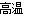 Si+2CO↑
Si+2CO↑
(2)分馏(或蒸馏)
(3)①浓硫酸 使滴入烧瓶中的SiHCl3汽化
②有固体生成 在该反应温度下,普通玻璃会软化
SiHCl3+H2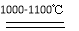 Si+3HCl
Si+3HCl
③排尽装置内的空气
【解析】分离沸点不同的液体的方法是分馏,根据题干“SiHCl3能与H2O强烈反应,在空气中易自燃”可知道H2的作用之一就是排尽装置内空气,防止SiHCl3自燃,而此处的H2必须是干燥的,可知B的作用就是干燥H2,所以选用浓硫酸。由于通入D中应是稳定的SiHCl3与过量H2的气流,所以C装置需要加热,并且是水浴加热,由D装置应加热到1 000~1 100 ℃,所以必须用石英管。

 阅读快车系列答案
阅读快车系列答案分析以下两个案例,回答后面问题。
(1)某城镇生产、生活的分布情况如图所示,河流中W、X、Y、Z处某次水样抽测结果如表所示。
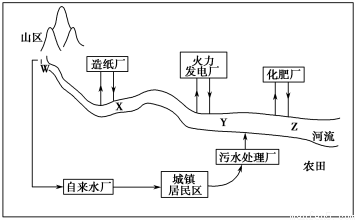
地点 项目 | W | X | Y | Z |
水温/℃ | 15 | 18 | 26 | 25 |
pH | 6 | 8 | 5 | 5 |
溶解氧量/(mg·L-1) | 11 | 9 | 7 | 3 |
①导致X、Y处水样pH变化的原因可能是______________________________;
②Z处鱼类大量减少,产生这种现象的原因可能是_________________________。
(2)某地区已探明蕴藏有丰富的赤铁矿(主要成分为Fe2O3、还含有SiO2等杂质)、煤矿、石灰石和黏土。拟在该地区建设大型炼铁厂。
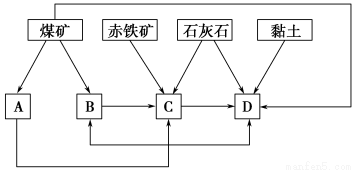
①随着铁矿的开发和炼铁厂的建立,需要在该地区相应建立焦化厂、发电厂、水泥厂等,形成规模的工业体系。据此确定上图中相应工厂的名称A________、B________、C________、D________;
②以赤铁矿为原料,写出高炉炼铁中得到生铁和产生炉渣的化学方程式_____________________________________________________________;
③从“三废”利用、环境保护等角度考虑,该地区和企业在生产中应采取的一些措施有____________(列举2种即可)。