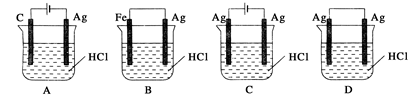
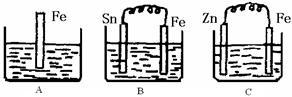
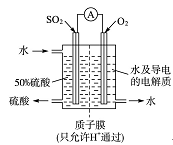
题目内容
人造地球卫星用到的一种高能电池——银锌蓄电池,其电极分别是Ag2O和Zn,电解液是KOH溶液。该电池的电极反应式为Zn+2OH--2e-=Zn(OH)2,Ag2O+H2O+2e-=2Ag+2OH-。下列说法中正确的是( )
①锌为负极,Ag2O为正极;②放电时,正极附近溶液OH-浓度增大;③工作时电流由Ag2O极经外电路流向Zn极;④溶液中阴离子向正极方向移动,阳离子向负极方向移动
①锌为负极,Ag2O为正极;②放电时,正极附近溶液OH-浓度增大;③工作时电流由Ag2O极经外电路流向Zn极;④溶液中阴离子向正极方向移动,阳离子向负极方向移动
| A.① | B.①②④ | C.①②③ | D.①②③④ |
C
试题分析:根据电池反应式Ag2O+Zn=2Ag+ZnO知,失电子的物质作负极,得电子的物质作正极,原电池放电时,电子从负极沿导线流向正极;根据电池电极附近氢离子或氢氧根离子浓度的变化判断溶液PH值的变化。
④溶液中阴离子向负极方向移动,阳离子向正极方向移动,故错。故选C。
故选C。
点评:本题考查了原电池原理,难度不大,明确原电池正负极的判断方法、外电路中电子的流向、电极附近离子浓度的变化导致溶液PH值的变化即可解答本题。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目