��Ŀ����
����Ŀ����֪���Ը��������Һ���Խ�FeSO4����������ʽΪ��2KMnO4+10FeSO4+8H2SO4=K2SO4+2MnSO4+5Fe2(SO4)3+8H2O���ֽ�һ�����������ữ�ĸ��������Һ������������Һ��ϣ���ַ�Ӧ������������Һ�м���KI��Һ�������Һ�������ӵ����ʵ���������KI�����ʵ����ı仯��ϵ��ͼ��ʾ���������й�˵���������( )
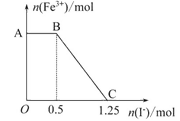
A. ͼ��AB����Ҫ�Ǹ�����غ͵⻯����Һ��Ӧ
B. ͼ��BC�η����ķ�ӦΪ2Fe3++2I-=2Fe2++I2
C. ����OC�ε����ݿ�֪��ʼ������������������ʵ���Ϊ1.25mol
D. ����OC�ε����ݿ�֪��ʼ����ĸ�����ص����ʵ���Ϊ0.25mol
���𰸡�C
��������A���AB�Σ���ʼʱFe3����Ũ�Ȳ��䣬��˵��Fe3��û����I����Ӧ������ֻ������FeSO4��Ӧʱʣ���KMnO4��I�������˷�Ӧ������A��ȷ��B�BC����Fe3����Ũ����Сֱ��Ϊ0��˵����Fe3����I�������˷�Ӧ����Ӧ�����ӷ���ʽ�ǣ�2Fe3++2I-=2Fe2++I2����B��ȷ��C�����A�������֪�����������Һ������������Һ��Ӧʱ���������ʣ�࣬������������ȫ��Ӧ��Fe2��ȫ��������Fe3�����ٸ���B�������֪��BC�η�������Fe3����I����Ӧ����ʱ����n��I����=��1.25-0.5��mol=0.75mol�����ɹ�ϵʽ��1 Fe2����1 Fe3����1 I����n��Fe2����=0.75mol�����������������ʵ���ӦΪ0.75mol������C������D�����C��ó�������n��FeSO4��=0.75mol����2KMnO4+10FeSO4+8H2SO4=K2SO4+2MnSO4+5Fe2(SO4)3+8H2O�ù�ϵʽ��1KMnO4��5FeSO4��������FeSO4��Ӧ��KMnO4���ʵ�����![]() = 0.15mol������ΪAB�η������ǣ�2MnO4����10I����16H��=2Mn2����5I2��8H2O���ù�ϵʽ��1 MnO4����5 I����AB������I�������ʵ�����n��I����=0.5mol��������I����Ӧ��KMnO4��0.1mol�����KMnO4���У�0.15mol+0.1mol��=0.25mol����D��ȷ�������ѡC��
= 0.15mol������ΪAB�η������ǣ�2MnO4����10I����16H��=2Mn2����5I2��8H2O���ù�ϵʽ��1 MnO4����5 I����AB������I�������ʵ�����n��I����=0.5mol��������I����Ӧ��KMnO4��0.1mol�����KMnO4���У�0.15mol+0.1mol��=0.25mol����D��ȷ�������ѡC��