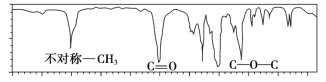
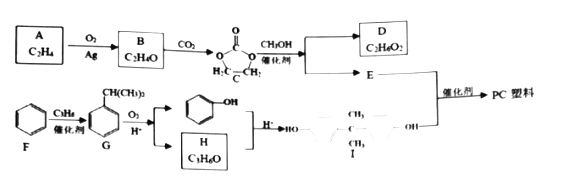
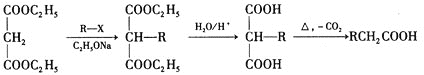题目内容
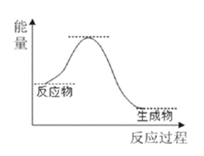
【题目】某温度时,N2与H2反应过程中的能量变化如图所示。下列叙述正确的是( )
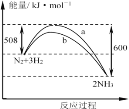
A.正反应的活化能等于逆反应的活化能
B.a曲线是加入催化剂时的能量变化曲线
C.1moN2与3moH2充分反应放出的热量小于92kJ
D.增大压强,可以提高反应物活化分子百分数
【答案】C
【解析】
A.由图象可知,正反应的活化能小于逆反应的活化能,故A错误;
B.催化剂能降低反应的活化能,所以b曲线是加入催化剂时的能量变化曲线,故B错误;
C.△H=正反应活化能-逆反应活化能=508kJ/mol-600kJ/mol=-92kJ/mol,但是该反应为可逆反应,1 mo N2与3 mo H2反应不能全部转化为1mol氨气,所以放出的热量小于92 kJ,故C正确;
D.增大压强可以提高单位体积内活化分子的数目,但不能提高物活化分子百分数,故D错误;
故答案为C。

练习册系列答案
相关题目