题目内容
(4分)水的电离平衡如图所示.

(1)若A点表示25℃时水的电离平衡状态,当升高温度至100℃时水的电离平衡状态为B点,则此时水的离子积为
(2)将100℃时p H=8的Ba(OH)2溶液与pH=5的盐酸混合,并保持100℃的恒温,欲使混合溶液的pH=7,则Ba(OH)2溶液与盐酸的体积比为
H=8的Ba(OH)2溶液与pH=5的盐酸混合,并保持100℃的恒温,欲使混合溶液的pH=7,则Ba(OH)2溶液与盐酸的体积比为 

(1)若A点表示25℃时水的电离平衡状态,当升高温度至100℃时水的电离平衡状态为B点,则此时水的离子积为
(2)将100℃时p
 H=8的Ba(OH)2溶液与pH=5的盐酸混合,并保持100℃的恒温,欲使混合溶液的pH=7,则Ba(OH)2溶液与盐酸的体积比为
H=8的Ba(OH)2溶液与pH=5的盐酸混合,并保持100℃的恒温,欲使混合溶液的pH=7,则Ba(OH)2溶液与盐酸的体积比为 
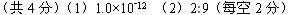
略

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 ________25 ℃。
________25 ℃。 ________25 ℃。
________25 ℃。 H =11的苛性钠溶液a L与pH=1的稀硫酸b L混合(设混合后溶液体积的微小变化忽略不计),所得混合液为中性,求a∶b等于多少?
H =11的苛性钠溶液a L与pH=1的稀硫酸b L混合(设混合后溶液体积的微小变化忽略不计),所得混合液为中性,求a∶b等于多少? ol/L的Ba(OH)2溶液,③pH=10的Na2S溶液
ol/L的Ba(OH)2溶液,③pH=10的Na2S溶液 ,④pH=5的NH4NO3溶液中,发生电离的水的物
,④pH=5的NH4NO3溶液中,发生电离的水的物 质的量之比是( )
质的量之比是( ) →D→ → → H
→D→ → → H