��Ŀ����
����Ŀ�������£���0.1000 mol/ L NaOH ��Һ�ֱ�ζ�20.00 mL 0.1000 mol/L HCl��Һ��20.00 mL 0.1000 mol/LCH3COOH��Һ���õ�2 ���ζ����ߣ�����ͼ��ʾ:

��1����A��C���жϣ��ζ�HCl��Һ��������_____(����ͼ1������ͼ2��)��
��2��a=____ mL��
��3��c(Na+ )=c(CH3COO-)�ĵ���_________��
��4��E���Ӧ����Ũ���ɴ�С��˳��Ϊ___________________________��
��5����NaOH ��Һ�ζ�CH3COOH ��Һ�����У�NaOH��Һ������10.00 mLʱ�����ʱ���Һ��c(CH3COOH)____c (CH3COO-)(��>������<������=�� )��
��6����25�� ʱ����c mol/L�Ĵ�����Һ��0.2mol/LNaOH��Һ�������Ϻ���Һǡ�������ԣ��ú�c �Ĵ���ʽ��ʾCH3COOH �ĵ��볣��Ka=___________��
���𰸡� ͼ1 20.00 D c(Na��)>c(CH3COO��)>c(OH��)>c(H��) �� ![]()
����������1�����⿼��һԪǿ����һԪ����ıȽϣ�HCl����ǿ�ᣬ0.1mol��L��1��HCl��Һ��pH=1��CH3COOH�����ᣬ0.1mol��L��1��CH3COOH��Һ��pH>1������ͼ�����㣬ͼ1Ϊ�ζ�HCl�����ߣ�ͼ2Ϊ�ζ�CH3COOH�����ߣ���2�����⿼���кͷ�Ӧ��������ǡ����ȫ��Ӧʱ����Һ��pH=7��������NaOH�����Ϊ20.00mL����3����������Ũ�ȴ�С�ȱȽϣ����ݵ���غ㣬c(Na��)��c(H��)=c(CH3COO��)��c(OH��)����Ϊc(Na��)=c(CH3COO��)����c(H��)=c(OH��)��D�����Ҫ��4�����⿼������Ũ�ȴ�С�Ƚϣ����ݣ�2����E���������������ǡ����ȫ��Ӧ������ΪCH3COONa������Ũ�ȴ�С˳����c(Na��)>c(CH3COO��)>c(OH��)>c(H��)����5�����⿼������Ũ�ȴ�С�Ƚϣ�NaOH��Һ����10.00mL����ʱ��Һ������ΪCH3COOH��CH3COONa���������ʵ�����ȣ�����ͼ�������������Ƶ����Ϊ10.00mLʱ����Һ�����ԣ�˵��CH3COOH�ĵ���̶ȴ���CH3COO����ˮ��̶ȣ���c(CH3COOH)<c(CH3COO��)����6�����⿼�����ƽ�ⳣ���ļ��㣬���ݵ���غ㣬c(Na��)��c(H��)=c(CH3COO��)��c(OH��)������Ϊc(Na��)=c(CH3COO��)��c(CH3COO��)=0.2/2mol/l=0.1mol/l��c(CH3COOH)=(c/2��0.1)mol��L��1����Һǡ��Ϊ���ԣ�c(H��)=10��7mol��L��1������ƽ�ⳣ��ֻ���¶ȵ�Ӱ�죬��K= 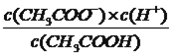 =
= 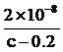 ��
��

 ͬ��ѧ��һ�ζ���ϵ�д�
ͬ��ѧ��һ�ζ���ϵ�д� �����ܾ�ϵ�д�
�����ܾ�ϵ�д� ���ƿ�����ϵ�д�
���ƿ�����ϵ�д�����Ŀ����֪25��ʱ�����ᡢ̼�ᡢ������ĵ���ƽ�ⳣ�����±�:(��λʡ��)
���� | ̼�� | ������ |
Ka=1.7��10-5 | Ka1=4.2��10-7 Ka2=5.6��10-11 | Ka=6.2��10-10 |
(1)д��̼��ĵ�һ�����뷽��ʽ___________��
(2)25��ʱ����Ũ�ȵ�������Һ��NaCN ��Һ����Na2CO3��Һ����CH3COONa ��Һ��pH�ɴ�С��˳��Ϊ_______(�����)��
(3)25��ʱ����NaCN��Һ��ͨ������CO2����Ӧ�����ӷ���ʽΪ___________��
(4)��Ũ��Ϊ0.02mol/L��HCN ��0.01mol/LNaOH ��Һ�������ϣ���û����Һ��c(Na+)>c(CN-)�����й�ϵ��ȷ����_______��
a.c(H+)-) b.c(H+)+c(HCN)=c(OH-) c.c(HCN)+c(CN-)=0.01mol/L
(5)25��ʱ��Ũ�Ⱦ�Ϊ0.01mol/L�Ģ�NaCN����CH3COONa����NaCl ��Һ�У���������Ũ���ɴ�С��˳��Ϊ_______(�����)��
(6)NaCN��һ����Ҫ�Ļ�������ԭ�ϣ�ͬʱҲ��һ�־綾���ʣ�����Σ�����ཡ�����������·����ⶨ������ķ�ˮ��NaCN�ĺ�������֪��
�ٷ�ˮ��NaCN ������ŷű�Ϊ0.50mg/L��
��Ag+ +2CN-=[Ag(CN)2]-��Ag++I-=AgI����AgI�����ʻ�ɫ����CN- ������Ag+��Ӧ��
ʵ�����£�20.00mL������ĺ�NaCN �ķ�ˮ����ƿ�У����μӼ���KI ��Һ��ָʾ������1.00��10-4mol/L�ı�AgNO3��Һ�ζ�������AgNO3��Һ�����Ϊ15.00mL��
�ٵζ�ʱ1.00��10-4mol/L�ı�AgNO3��ҺӦ��______(����������)ʢװ���ζ��յ�ʱ��������_________��
�ڴ�����ĺ�NaCN �ķ�ˮ�Ƿ�ﵽ�ŷű�_____(��ǡ���)��


