题目内容
下列用来表示物质变化的反应式中,错误的是
| A.钢铁腐蚀时可能发生的正极反应:2H2O + O2 + 4e- = 4OH- |
| B.向KHSO4溶液中滴入Ba(OH)2溶液使pH=7:SO42- + 2 H+ + Ba2+ + 2OH-= BaSO4↓+ 2 H2O |
C.明矾水解的离子方程式:Al3+ + 3H2O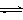 Al(OH)3 + 3H+ Al(OH)3 + 3H+ |
| D.K37ClO3与浓盐酸(HCl)在加热时生成氯气:K37ClO3 + 6HClΔ K37Cl + 3Cl2↑+ 3H2O |
D
解析试题分析: D、K37ClO3与浓盐酸(HCl)在加热时生成氯气时,37Cl应该在产物氯气中。错误。
考点:考查电池、离子方程式的书写、氧化还原反应。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
设NA为阿伏加德罗常数的数值,下列说法错误的是
| A.标准状况下,22.4 LCl2和HCl的混合气体中含原子总数为2NA |
| B.256g S8晶体中含S-S键为7NA个 |
| C.由1molCH3COONa和少量CH3COOH形成的中性溶液中,CH3COO-数目为NA个 |
| D.1 mol Na与O2完全反应,生成Na2O和Na2O2的混合物,转移电子总数NA个 |
化学用语是学习化学的重要工具,下列化学用语正确的是
A. 表示14C原子结构示意图 表示14C原子结构示意图 |
B. 表示CCl4分子的比例模型 表示CCl4分子的比例模型 |
| C.HClO的结构式:H—Cl—O |
D. 表示1,1,2,2-四溴乙烷 表示1,1,2,2-四溴乙烷 |
设NA为阿伏加德罗常数的值。下列说法正确的是
| A.常温常压下,15 g甲基(-CH3)所含的电子数为7NA |
| B.水的摩尔质量就是NA个水分子的质量之和 |
| C.含NA个Na+的Na2O2溶于1L水中,Na+的物质的量浓度为1mol/L |
| D.1 mo1Mg与足量O2或N2反应生成MgO或Mg3 N2均失去2NA个电子 |
在NaCl、MgCl2和MgSO4三种盐配成的混合溶液中,若Na+为0.1 mol,Mg2+为0.25 mol,Cl-为0.2 mol,则SO42-的物质的量为( )。
| A.0.5 mol | B.0.15 mol | C.0.2 mol | D.0.25 mol |
若20 g密度为ρ g·cm-3的Ca(NO3)2溶液中含有2 g Ca(NO3)2,则溶液中NO3-的物质的量浓度为( )
A.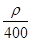 mol·L-1 mol·L-1 | B.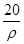 mol·L-1 mol·L-1 |
C.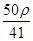 mol·L-1 mol·L-1 | D.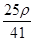 mol·L-1 mol·L-1 |
设NA代表阿伏加德罗常数,下列叙述正确的是( )
| A.标准状况下2.24 L H2O中,分子数为0.1 NA |
| B.将1 mol Cl2通入到水中,则N(HClO)+N(Cl-)+N(ClO-)=2NA |
| C.常温常压下16 g O2和O3混合气体中,氧原子数为NA |
| D.7.8 g Na2O2与足量水反应,转移电子数为0.2NA |
如图是NaCl、MgSO4的溶解度曲线。下列说法正确的是 ( )
| A.只有在t1℃时,NaCl和MgSO4的溶解度才相等 |
| B.t1~t2℃,MgSO4的溶解度随温度升高而减小 |
| C.在t2℃时,MgSO4饱和溶液的溶质质量分数最大 |
| D.把MgSO4饱和溶液的温度从t3℃降至t2℃时,有晶体析出 |
用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A.24 g NaH中阴离子所含电子总数为NA |
| B.标准状况下,22.4 L苯中含有C—H键数目为6NA |
C.在碳酸钠溶液中,若c(C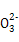 )="1" mol/L,则c(Na+)="2" mol/L )="1" mol/L,则c(Na+)="2" mol/L |
| D.通过MnO2催化使H2O2分解,产生32 g O2时转移电子数为2NA |