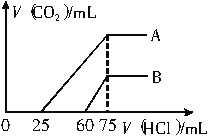
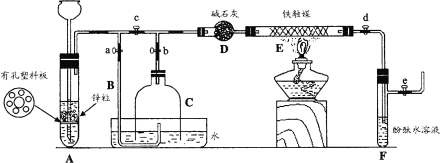
题目内容
【题目】下列关于金属的说法中不正确的是( )
A. 合金比纯金属具有较好的性能,一般情况下,硬度比纯金属高,熔点比纯金属的低
B. 合金仍然具有金属特性
C. 常用电解法冶炼钠、镁、铝等活泼金属
D. 将钢闸门与电源正极相连,可防止其在海水中被腐蚀
【答案】D
【解析】A.合金的硬度大,熔点低,故A正确;B.合金是指在一种金属中加热熔合其它金属或非金属而形成的具有金属特性的物质,故B正确; C.活泼金属如Na、Mg、Al常用电解法冶炼,故C正确;D.将钢闸门与直流电源的正极相连,钢闸作阳极,活泼金属铁作阳极,容易失去电子而被腐蚀,所以将钢闸门与直流电源的正极相连不能防止其被腐蚀,反而能加快被腐蚀,故D错误;故选D。

【题目】某原电池总反应的离子方程式是:Zn+Cu2+═Zn2++Cu,依据此反应设计原电池的正确组合是( )
选项 | 正极 | 负极 | 电解质溶液 |
A | Cu | Zn | 稀盐酸 |
B | C | Zn | 硫酸铜溶液 |
C | Cu | Zn | 氯化铜溶液 |
D | Cu | Zn | 硝酸铜溶液 |
A.A
B.B
C.C
D.D
【题目】从某废液(含有Fe2+、Cu2+、Cl-)中回收铜并制得纯净的FeCl3溶液。现以制得纯净的FeCl3溶液为原料制取优良的水处理剂高铁酸钾(K2FeO4),其流程如下:

已知:高锰酸钾(K2FeO4)位暗紫色固体,可溶于水。在中性或酸性溶液中逐渐分解,在碱性溶液中稳定。高锰酸钾具有强氧化性。高锰酸钾(K2FeO4)与水作用产生Fe(OH)3。
(1)检验废液中含有Fe2+选用的试剂是________(填化学式);从废液中制得纯净的FeCl3溶液加入的试剂除铁粉外,还需要一种试剂是_________(填化学式),加入时发生反应的离子方程式为__________。
(2)高锰酸钾(K2FeO4)在处理水过程中的作用是_________和__________。
(3)“氧化”过程反应的离子方程式为__________。
(4)过滤时需用的玻璃仪器有玻璃棒、烧杯和________,上述工艺得到的高锰酸钾常含有杂志,可用重结晶法提纯,操作是:将粗产品用_________溶解,然后________。
(5)用回收的铜为原料可制得粗制CuSO4·5H2O晶体(含有少量的FeSO4·7H2O),除去CuSO4·5H2O晶体中杂志的方法是:向溶液中加入H2O2,再调解溶液PH,过滤即可制得纯净的CuSO4溶液,进而制得纯净CuSO4·5H2O的晶体。
已知:室温时一些物质的Kaq如下表:
化学式 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
Kaq | 8.0×10-16 | 8.0×10-18 | 8.0×10-20 |
已知溶液中的离子浓度小于1×10-6mol·L-1时就认定沉淀完全。
加双氧水的目的是__________;若溶液中CuSO4的浓度为3.0mol·L-1,通过计算说明此方法可除去粗制CuSO4·5H2O晶体中FeSO4·7H2O的理由________。