题目内容
(2012?唐山三模)【化学--物质结构与性质】
氧气素与多种元素具有亲和力,所形成化合物的类仅次于碳元素.
(1)氮、氧、氟元素的第一电离能从大到小的顺序为
(2)根据等电子原理,判断NO2+离子中,氮原子轨道的杂化类型为
(3)氧元素与过渡元素可以形成多种价态的金属氧化物.如铬可生成Cr2O3、CrO3、CrO5等,试写出Cr3+核外电子排布式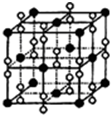
(4)钙在氧气中燃烧时得到一种钙的氧化物晶体,其结构如图所示.
由此可判断该钙的氧化物的化学式为
已知晶胞边长为a cm,则该氧化物的密度是
g?cm-3(只要求列算式,不必计算出数值,阿伏加德罗常数为NA).
氧气素与多种元素具有亲和力,所形成化合物的类仅次于碳元素.
(1)氮、氧、氟元素的第一电离能从大到小的顺序为
F>N>O
F>N>O
,氧元素与氟元素能形成OF2分子,该分子的空间构型为V型
V型
.(2)根据等电子原理,判断NO2+离子中,氮原子轨道的杂化类型为
sp
sp
,1molNO2+所含π键的数目为2NA
2NA
.(3)氧元素与过渡元素可以形成多种价态的金属氧化物.如铬可生成Cr2O3、CrO3、CrO5等,试写出Cr3+核外电子排布式
1s22s22p63s23p63d3
1s22s22p63s23p63d3
.
(4)钙在氧气中燃烧时得到一种钙的氧化物晶体,其结构如图所示.
由此可判断该钙的氧化物的化学式为
CaO2
CaO2
.已知晶胞边长为a cm,则该氧化物的密度是
| 4×72 |
| a3×NA |
| 4×72 |
| a3×NA |
分析:(1)同周期自左而右元素第一电离能呈增大趋势,但氮元素2p能级容纳3个电子,处于半满稳定状态,第一电离能共用同周期相邻元素;计算氧原子价层电子对数与孤电子对确定OF2分子空间构型;
(2)NO2+离子与CO2为等电子体,二者具有相同的结构;
(3)Cr原子核外有24个电子,失去4s能级1电子、3d能级的2个电子形成Cr3+;
(4)黑色球为Ca、白色球为O,根据均摊法计算晶胞中钙离子与O22-的数目;根据其摩尔质量计算晶胞质量,根据ρ=
计算密度.
(2)NO2+离子与CO2为等电子体,二者具有相同的结构;
(3)Cr原子核外有24个电子,失去4s能级1电子、3d能级的2个电子形成Cr3+;
(4)黑色球为Ca、白色球为O,根据均摊法计算晶胞中钙离子与O22-的数目;根据其摩尔质量计算晶胞质量,根据ρ=
| m |
| V |
解答:解:(1)同周期自左而右元素第一电离能呈增大趋势,但氮元素2p能级容纳3个电子,处于半满稳定状态,能量较低,第一电离能共用同周期相邻元素,故第一电离能,F>N>O;氧原子价层电子对数=2+
=4、含有2对孤对电子,故OF2分子为V型,
故答案为:F>N>O;V型;
(2)CO2中C原子与氧原子之间形成C=O是,成2个σ键、不含孤对电子,碳原子采取sp杂化,NO2+离子与CO2为等电子体,具有相同的结构,故N原子也采取sp杂化,N原子与氧原子之间也形成N=O双键,故1molNO2+所含π键的数目为2NA,
故答案为:sp;2NA;
(3)Cr原子核外有24个电子,核外电子排布为1s22s22p63s23p63d54s1,失去4s能级1电子、3d能级的2个电子形成Cr3+,故Cr3+核外电子排布式1s22s22p63s23p63d3,
故答案为:1s22s22p63s23p63d3;
(4)由晶体的晶胞结构图可知,O22-占据棱点和体心,个数为12×
+1=4,钙离子占据顶点和面心,个数为8×
+6×
=4,个数比为1:1,则化学式为CaO2;晶胞质量为
g,晶胞体积为a3 cm3,故晶胞密度=
=
g/cm3,
故答案为:CaO2;
.
| 6-1×2 |
| 2 |
故答案为:F>N>O;V型;
(2)CO2中C原子与氧原子之间形成C=O是,成2个σ键、不含孤对电子,碳原子采取sp杂化,NO2+离子与CO2为等电子体,具有相同的结构,故N原子也采取sp杂化,N原子与氧原子之间也形成N=O双键,故1molNO2+所含π键的数目为2NA,
故答案为:sp;2NA;
(3)Cr原子核外有24个电子,核外电子排布为1s22s22p63s23p63d54s1,失去4s能级1电子、3d能级的2个电子形成Cr3+,故Cr3+核外电子排布式1s22s22p63s23p63d3,
故答案为:1s22s22p63s23p63d3;
(4)由晶体的晶胞结构图可知,O22-占据棱点和体心,个数为12×
| 1 |
| 4 |
| 1 |
| 8 |
| 1 |
| 2 |
| 4×72 |
| NA |
| ||
| a3 cm3 |
| 4×72 |
| a3×NA |
故答案为:CaO2;
| 4×72 |
| a3×NA |
点评:本题池物质结构与性质综合题目,涉及电离能、核外电子排布、杂化理论与分子结构、晶胞计算等,难度中等,注意同周期中元素原子处于全满、半满稳定状态时,其第一电离能有较高异常现象.

练习册系列答案
相关题目
 (2012?唐山三模)咖啡酸可用作化学原料和中间体,其结构如图.下列关于咖啡酸的说法中不正确的是( )
(2012?唐山三模)咖啡酸可用作化学原料和中间体,其结构如图.下列关于咖啡酸的说法中不正确的是( )