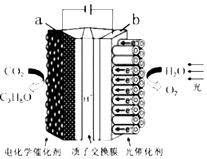
题目内容
【题目】下列说法不正确的是( )
A.加入苯酚显紫色的溶液:K+、NH4+、Cl﹣、I﹣;加入酚酞呈红色的溶液:SO42﹣、K+、Cl﹣、HSO3﹣分别都不能大量共存(常温下)
B.![]() =1×10﹣12的溶液:K+、AlO2﹣、CO32﹣、Na+; pH=2的溶液:NO3﹣、Fe2+、Na+、Al3+分别都可以大量共存(常温下)
=1×10﹣12的溶液:K+、AlO2﹣、CO32﹣、Na+; pH=2的溶液:NO3﹣、Fe2+、Na+、Al3+分别都可以大量共存(常温下)
C.已知:25℃时,Mg(OH)2的Ksp=5.61×10﹣12 , MgF2的KSP=7.42×10﹣11 , 25℃时,在Mg(OH)2的悬浊液中加入NaF溶液后,Mg(OH)2 可以转化为MgF2
D.表示H2燃烧热的化学方程式为:H2(g)+ ![]() O2(g)═H2O(1);△H=﹣285.8kJ/mol
O2(g)═H2O(1);△H=﹣285.8kJ/mol
【答案】B
【解析】解:A.加入苯酚显紫色的溶液中存在铁离子,铁离子能够氧化I﹣ , 在溶液中不能共存;加入酚酞呈红色的溶液呈碱性,HSO3﹣与氢氧根离子反应,在溶液中也不能共存,故A正确;
B. ![]() =1×10﹣12的溶液中存在大量氢氧根离子,K+、AlO2﹣、CO32﹣、Na+之间不反应,都不与氢氧根离子反应,能够大量共存; pH=2的溶液呈酸性,NO3﹣、Fe2+在酸性条件下发生氧化还原反应,在溶液中不能大量共存,只有前者能够共存,故B错误;
=1×10﹣12的溶液中存在大量氢氧根离子,K+、AlO2﹣、CO32﹣、Na+之间不反应,都不与氢氧根离子反应,能够大量共存; pH=2的溶液呈酸性,NO3﹣、Fe2+在酸性条件下发生氧化还原反应,在溶液中不能大量共存,只有前者能够共存,故B错误;
C.二者的Ksp接近,加入浓NaF溶液可以使Mg(OH)2转化为MgF2 , 故C正确;
D.氢气燃烧生成的稳定氧化物为液态水,则H2燃烧热的化学方程式为:H2(g)+ ![]() O2(g)═H2O(1)△H=﹣285.8kJ/mol,故D正确;
O2(g)═H2O(1)△H=﹣285.8kJ/mol,故D正确;
故选B.

 名题金卷系列答案
名题金卷系列答案 优加精卷系列答案
优加精卷系列答案【题目】已知用硫酸酸化的草酸(H2C2O4)溶液能与KMnO4溶液反应.某化学小组研究发现,少量MnSO4可对该反应起催化作用.为进一步研究有关因素对该反应速率的影响,探究如下:
(1)常温下,探究不同的初始pH和草酸溶液浓度对反应速率的影响,设计如下实验,则A= , C= , E=
实验编号 | 温度 | 初始pH | 0.1mol/L草酸溶液体积/mL | 0.01mol/LKMnO4 | 蒸馏水体积/mL | 待测数据(混合液褪色时间/s) |
① | 常温 | 1 | 20 | 50 | 30 | t1 |
② | 常温 | A | B | C | 30 | t2 |
③ | 常温 | 2 | 40 | D | E | t3 |
(2)该反应的离子方程式 .
(3)若t1<t2 , 则根据实验①和②得到的结论是 .
(4)小组同学发现每组实验反应速率随时间的变化总是如图,其中t1~t2时间内速率变快的主要原因可能是: 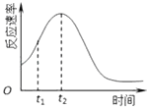
①;②
(5)化学小组用滴定法测定KMnO4溶液物质的量浓度:取ag草酸晶体(H2C2O42H2O,摩尔质量126g/mol)溶于水配成250mL溶液,取25.00mL溶液置于锥形瓶中,加入适量稀H2SO4酸化,再用KMnO4溶液滴定至终点,重复滴定三次,平均消耗KMnO4溶液VmL.滴定到达终点的现象是:;实验中所需的定量仪器有(填仪器名称).该KMnO4溶液的物质的量浓度为mol/L.