题目内容
【题目】在100mL NaOH溶液中加入NH4NO3和(NH4)2SO4的固体混合物,加热充分反应,如图表示加入的混合物质量与产生的气体体积(标准状况)的关系,试计算: 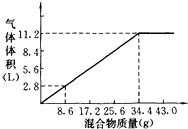
(1)NaOH的物质的量浓度;
(2)当NaOH溶液的体积为140mL,固体混合物的质量是51.6g时,充分反应后,生成气体的体积(标准状况)为L.
(3)当NaOH溶液的体积为180mL,固体混合物的质量仍为51.6g时,充分反应后,生成气体的体积(标准状况)为L.
【答案】
(1)5mol/L
(2)15.68
(3)16.8
【解析】解:(1)氢氧化钠与NH4NO3和(NH4)2SO4的混合物生成氨气,发生反应NH4++OH﹣ ![]() NH3↑+2H2O,从图中可看出34.4 g混合物和100 mL NaOH恰好完全反应.则n(NaOH)=n(NH3)=
NH3↑+2H2O,从图中可看出34.4 g混合物和100 mL NaOH恰好完全反应.则n(NaOH)=n(NH3)= ![]() =0.5 mol c(NaOH)=
=0.5 mol c(NaOH)= ![]() =5mol/L,
=5mol/L,
所以答案是:5mol/L;(2)当固体混合物的质量是51.6 g时,固体混合物完全反应消耗的氢氧化钠溶液的体积为: ![]() ×100ml=150ml,而V(NaOH)=140 mL,说明固体过量,所以n(NH3)=n(NaOH)=5 mol/L×0.14 L=0.7mol,V(NH3)=0.7mol×22.4 L/mol=15.68 L,
×100ml=150ml,而V(NaOH)=140 mL,说明固体过量,所以n(NH3)=n(NaOH)=5 mol/L×0.14 L=0.7mol,V(NH3)=0.7mol×22.4 L/mol=15.68 L,
所以答案是:15.68;(3)由(2)分析可知,当V(NaOH)=180 mL时,说明NaOH过量,则固体51.6 g完全反应,故V(NH3)=11.2L× ![]() =16.8 L,
=16.8 L,
所以答案是:16.8.

练习册系列答案
相关题目