题目内容
将1.0g Al2O3和MgO的混合物,溶解在过量的100mL浓度为0.5mol/L的硫酸溶液中,然后向其中加入NaOH溶液,使Al3+、Mg2+刚好全部转化为沉淀,所用100mLNaOH溶液的物质的量浓度为
- A.0.5mol/L
- B.1.0mol/L
- C.1.5mo l/L
- D.2.0 mo l/L
试题分析:根据最后溶液中存在的物质为硫酸钠,可以得出钠离子和硫酸根离子的物质量之比为1/2,可知氢氧化钠的物质量的浓度为1.0mol/L
考点:考察溶液中电荷守恒知识点。
点评:本题的关键是利用溶液呈电中性,所以可以用电荷守恒来解题,这样可以简化解题过程。

 口算能手系列答案
口算能手系列答案将1.0g Al2O3和MgO的混合物,溶解在过量的100mL浓度为0.5mol/L的硫酸溶液中,然后向其中加入NaOH溶液,使Al3+、Mg2+刚好全部转化为沉淀,所用100mLNaOH溶液的物质的量浓度为
| A.0.5mol/L | B.1.0mol/L | C.1.5mo l/L | D.2.0 mo l/L |
硼镁泥是一种工业废料,主要成份是MgO(占40%),还有CaO、MnO、Fe2O3、FeO、Al2O3、SiO2等杂质,以此为原料制取的硫酸镁,可用于印染、造纸、医药等工业。从硼镁泥中提取MgSO4·7H2O的工艺流程如下:
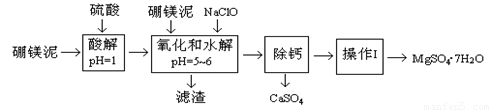
已知:NaClO与Mn2+反应产生MnO2沉淀。
|
沉淀物 |
Fe(OH)3 |
Al(OH)3 |
Fe(OH)2 |
|
开始沉淀pH |
2.3 |
4.0 |
7.6 |
|
完全沉淀pH |
4.1 |
5.2 |
9.6 |
根据题意回答下列问题:
(1)实验中需用1.00mol/L的硫酸80.0mL,若用98%的浓硫酸配制,除量筒、玻璃棒、胶头滴管外,还需要的玻璃仪器有 、 。
(2)滤渣的主要成份除含有Fe(OH)3、Al(OH)3外,还有 、 。
(3)加入的NaClO可与Mn2+反应产生MnO2沉淀,该反应的离子方程式: 。
在调节pH=5~6之前,还有一种离子也会被NaClO氧化,该反应的离子方程式为:
。
(4)为了检验滤液中Fe3+是否被除尽,可选用的试剂是 。
A.KSCN溶液 B.淀粉KI溶液 C.H2O2 D.KMnO4稀溶液
(5)已知MgSO4、CaSO4的溶解度如下表:
|
温度(℃) |
40 |
50 |
60 |
70 |
|
MgSO4 |
30.9 |
33.4 |
35.6 |
36.9 |
|
CaSO4 |
0.210 |
0.207 |
0.201 |
0.193 |
“除钙”是将MgSO4和CaSO4混合溶液中的CaSO4除去,根据上表数据,简要说明操作步骤 、 。
(6)如果测得提供的硼镁泥的质量为100.0g,得到的MgSO4·7H2O196.8g,则MgSO4·7H2O的产率为 (相对分子质量:MgSO4·7H2O-246 MgO-40)。

