题目内容
硫酸工业生产应考虑综合经济效益。?(1)若从下列四个地区选址新建一座硫酸厂,最合适的地点应在 附近。?
a.风景旅游区 b.硫酸消耗中心区? c.人口稠密区 d.黄铁矿矿区?
(2)工业生产硫酸的原料气成分(体积分数)为:SO27%,O211%,N2 82%。压强及温度对SO2转化率的影响如下:?
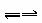
工业上,二氧化硫催化氧化过程采用的是常压而不是高压,主要原因是 。?
分析上表数据可知,二氧化硫的催化氧化是放热反应,理由是 。
(3)据测算,接触法制硫酸过程中,每生产1t 98%的硫酸需消耗3.60×105 kJ能量。若反应:2SO2(g)+O2(g)![]() 2SO3(g),ΔH =-196.6 kJ·mol-1放出的热量完全被利用,则每生产1t 98%的硫酸可为外界提供 kJ能量(不考虑其他过程释放的能量)。?
2SO3(g),ΔH =-196.6 kJ·mol-1放出的热量完全被利用,则每生产1t 98%的硫酸可为外界提供 kJ能量(不考虑其他过程释放的能量)。?
(4)依据题给数据计算:在500 ℃ 0.1 MPa条件下,二氧化硫的催化氧化达到平衡时,各种气体的体积比V(SO2)∶V(SO3)∶V(O2)∶V(N2)= ∶ ∶ ∶ (结果保留两位有效数字)。
(1)b?
(2)常压时SO2的转化率已经很大,增大压强会增加动力成本和设备成本压强一定时,温度升高,SO2转化率下降?
(3)6.23×105?
(4)V(SO2)∶V(SO3)∶V(O2)∶V(N2)=(0.46)∶(6.5)∶(7.7)∶82?
解析:
(2)从表中数据看,常压下SO2的转化率已很高,故无须加压。随强度的升高,SO2的转化率降低,故反应放热。?
(3)1t 98%的硫酸的物质的量为1×104 mol,故需SO31×104 mol,因此产生SO3需放热196.62×1×104 kJ=9.83×105kJ,故为外界提供:9.83×105 kJ-3.60×105 kJ=6.23×105kJ的热量。
(4)设SO2为7,O2为11,N2为82?
2SO2 + O2 ![]() 2SO3?
2SO3?
始: 7 11 0?
转:7×93.5% ![]() 7×93.5%?
7×93.5%?
平:7(1-93.5%) 11-![]() 7×93.5%?
7×93.5%?
故平衡时四者比为:0.46∶6.5∶7.7∶82

(8分)【化学—化学与技术】
硫酸工业生产应考虑综合经济效益问题。
(1)若从下列四个城市中选择一处新建一座硫酸厂,你认为厂址宜选在 的郊区(填标号);
A.有丰富黄铁矿资源的城市 B.风光秀丽的旅游城市
C.消耗硫酸甚多的工业城市 D.人口稠密的文化、商业中心城市
(2)CuFeS2 是黄铁矿的另一成分,煅烧时CuFeS2 转化为CuO、Fe2O3和SO2,该反应的化学方程式为 。
(3)在硫酸工业制法中,下列生产操作与说明生产操作的主要原因二者都是正确的是 。
A.黄铁矿燃烧前需要粉碎,因为大块的黄铁矿不能在空气中燃烧
B.从沸腾炉出来的炉气需净化,因为炉气中二氧化硫会与杂质反应
C.二氧化硫氧化为三氧化硫时需使用催化剂,这样可以提高二氧化硫的转化率
D.三氧化硫用98.3%的浓硫酸吸收,目的是防止形成酸雾,以提高三氧化硫的吸收效率
(4)由硫酸厂沸腾炉排出的矿渣中含有Fe2O3、CuO、CuSO4(由CuO与SO3在沸腾炉中化合而成),其中硫酸铜的质量分数随沸腾炉温度不同而变化(见下表)
| 沸腾炉温度/℃ | 600 | 620 | 640 | 660 |
| 炉渣中CuSO4的质量分数/% | 9.3 | 9.2 | 9.0 | 8.4 |