题目内容
11.某金属的硝酸盐受热分解生成NO2、O2该金属氧化物.已知NO2和O2的分子个数比为8:1,则在分解过程中该金属的化合价将( )| A. | 无法确定 | B. | 升高 | C. | 不变 | D. | 降低 |
分析 某金属的硝酸盐受热分解生成NO2、O2和某金属氧化物,氮元素化合价由+5价降低为+4价,氧元素化合价由-2价升高为0价,根据NO2和 O2的分子个数比为8:1,计算氮原子得到的电子、氧原子失去的电子.根据电子转移守恒,判断金属元素化合价变化
解答 解:某金属的硝酸盐受热分解生成NO2、O2和某金属氧化物,氮元素化合价由+5价降低为+4价,氧元素化合价由-2价升高为0价,NO2和O2的分子个数比为8:1,令NO2和 O2的分子个数分别为8、1,氮原子得到的电子数为8,氧原子失去的电子为1×2×[0-(-2)]=4,由氧化还原反应中得失电子数目相等可知,金属元素化合价应升高,失去电子.
故选B.
点评 本题考查氧化还原反应的计算,为高频考点,把握反应中元素的化合价变化及电子守恒为解答的关键,侧重分析与计算能力的考查,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
4.下列图示与对应的叙述相符的是( )
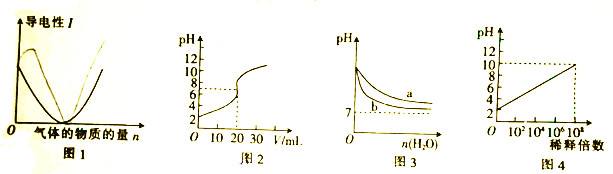

| A. | 图1可表示向醋酸溶液中通入氨气时,溶液导电性随氨气量的变化 | |
| B. | 图2所示实验为常温下用0.01mol•L-1的HCl溶液滴定20mL0.01mol•L-1的NaOH溶液 | |
| C. | 图2可表示常温下pH相同的NaOH溶液与氨水稀释过程的pH变化,其中曲线b是氨水的pH变化 | |
| D. | 图4可以表示常温下pH=2的HCl溶液加水稀释倍数与pH的变化关系 |
16.为提纯如表物质(括号内为杂质)选用的试剂和分离方法都正确的是( )
| 物质 | 试剂 | 分离方法 | |
| ① | KNO3(NaCl) | 蒸馏水 | 降温结晶 |
| ② | CO2(HCl) | 饱和Na2CO3溶液 | 洗气 |
| ③ | 乙酸乙酯(乙酸) | NaOH溶液 | 分液 |
| ④ | Cl2(HCl) | 饱和NaCl溶液 | 洗气 |
| A. | ①③ | B. | ①④ | C. | 只有 ④ | D. | ③④ |
3.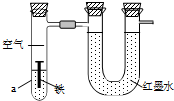 如图用来研究钢铁制品的腐蚀,装置的气密性良好,且开始时U形管两端的红墨水液面相平.一段时间后能观察到铁钉生锈.下列说法不正确的是( )
如图用来研究钢铁制品的腐蚀,装置的气密性良好,且开始时U形管两端的红墨水液面相平.一段时间后能观察到铁钉生锈.下列说法不正确的是( )
 如图用来研究钢铁制品的腐蚀,装置的气密性良好,且开始时U形管两端的红墨水液面相平.一段时间后能观察到铁钉生锈.下列说法不正确的是( )
如图用来研究钢铁制品的腐蚀,装置的气密性良好,且开始时U形管两端的红墨水液面相平.一段时间后能观察到铁钉生锈.下列说法不正确的是( )| A. | 铁钉表面发生的反应为Fe-3e-=Fe3+ | |
| B. | 若液体a为稀盐酸,则U形管液面右高左低 | |
| C. | 若液体a为食盐水,则U形管液面左高右低 | |
| D. | 若液体a为食用油,则铁钉生锈速率较慢 |
20.下列制取蒸馏水的实验装置与操作的说法中,不正确的是( )
| A. | 可用过滤的方法制取蒸馏水 | |
| B. | 冷凝器中的水流方向是从下口进入,上口排出 | |
| C. | 实验中需要在蒸馏烧瓶中加入几片碎瓷片或沸石 | |
| D. | 给蒸馏烧瓶加热时要垫上石棉网 |

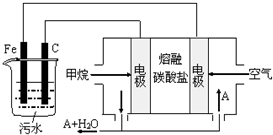 电浮选凝聚法是工业上采用的一种污水处理方法:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3沉淀.Fe(OH)3有吸附性,可吸附污 物而沉积下来,具有净化水的作用.阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,刮去(或撇掉)浮渣层,即起到了浮选净化的作用.某科研小组用电浮选凝聚法处理污水,设计装置示意图,如图所示.
电浮选凝聚法是工业上采用的一种污水处理方法:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3沉淀.Fe(OH)3有吸附性,可吸附污 物而沉积下来,具有净化水的作用.阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,刮去(或撇掉)浮渣层,即起到了浮选净化的作用.某科研小组用电浮选凝聚法处理污水,设计装置示意图,如图所示.