题目内容
下列排列顺序正确的是( )
①热稳定性:H2O>HF>H2S
②原子半径:Na>Mg>O
③非金属性:S>O>F
④酸性:H3PO4>H2SO4>HClO4
⑤碱性:NaOH>Mg(OH)2>Al(OH)3.
①热稳定性:H2O>HF>H2S
②原子半径:Na>Mg>O
③非金属性:S>O>F
④酸性:H3PO4>H2SO4>HClO4
⑤碱性:NaOH>Mg(OH)2>Al(OH)3.
| A、②⑤ | B、①③ | C、①④ | D、②③ |
考点:非金属在元素周期表中的位置及其性质递变的规律,同一主族内元素性质递变规律与原子结构的关系,金属在元素周期表中的位置及其性质递变的规律
专题:元素周期律与元素周期表专题
分析:①非金属性越强,气态氢化物越稳定;
②电子层越多,半径越大;同周期,原子序数大的半径小;
③同主族原子序数大的非金属性弱,同周期原子序数大的非金属性强;
④非金属性越强,最高价氧化物的水化物酸性越强;
⑤金属性越强,最高价氧化物的水化物碱性越强.
②电子层越多,半径越大;同周期,原子序数大的半径小;
③同主族原子序数大的非金属性弱,同周期原子序数大的非金属性强;
④非金属性越强,最高价氧化物的水化物酸性越强;
⑤金属性越强,最高价氧化物的水化物碱性越强.
解答:
解:①非金属性F>O>S,气态氢化物的稳定性为HF>H2O>H2S,故错误;
②电子层越多,半径越大;同周期,原子序数大的半径小,则原子半径为Na>Mg>O,故正确;
③同主族原子序数大的非金属性弱,同周期原子序数大的非金属性强,则非金属性:F>O>S,故错误;
④非金属性Cl>S>P,最高价氧化物的水化物酸性为H3PO4<H2SO4<HClO4,故错误;
⑤金属性Na>Mg>Al,最高价氧化物的水化物碱性为NaOH>Mg(OH)2>Al(OH)3,故正确;
故选A.
②电子层越多,半径越大;同周期,原子序数大的半径小,则原子半径为Na>Mg>O,故正确;
③同主族原子序数大的非金属性弱,同周期原子序数大的非金属性强,则非金属性:F>O>S,故错误;
④非金属性Cl>S>P,最高价氧化物的水化物酸性为H3PO4<H2SO4<HClO4,故错误;
⑤金属性Na>Mg>Al,最高价氧化物的水化物碱性为NaOH>Mg(OH)2>Al(OH)3,故正确;
故选A.
点评:本题考查元素的性质,为高频考点,把握同主族、同周期元素的性质比较规律为解答的关键,注意元素周期律的应用和规律性知识的归纳,题目难度不大.

练习册系列答案
相关题目
下列物质中,既可与新制Cu(OH)2悬浊液共热产生红色沉淀,又可与Na2CO3水溶液反应的是( )
| A、苯甲酸 | B、甲酸 |
| C、乙二酸 | D、乙醛 |
A、B两种烃,它们的最简式相同,下列关于A和B的叙述正确的是( )
| A、A和B一定是同分异构体 |
| B、A和B的摩尔质量一定相同 |
| C、A和B一定具有相同化学性质 |
| D、A和B可能不是同系物 |
下列有机反应方程式完全正确的是( )
A、甲苯的硝化反应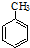 +3HONO2 +3HONO2
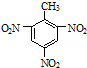 +3H2O +3H2O | |||
B、甲苯在光照条件下和氯气发生取代反应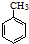 +Cl2→ +Cl2→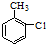 +HCl +HCl | |||
C、叔丁基苯和酸性高锰酸钾溶液反应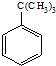 +KMnO4 +KMnO4
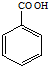 | |||
D、溴乙烷在NaOH溶液中水解CH3CH2Br+NaOH
|
下列物质的水溶液显酸性的是( )
| A、CH4 |
| B、CH3COOH |
| C、CH3CH2OH |
| D、CH3Br |
以下说法正确的是( )
| A、物质所含元素化合价升高的反应叫还原反应 |
| B、金属阳离子在氧化还原反应中不一定作氧化剂 |
| C、含非金属元素的离子,在氧化还原反应中作还原剂 |
| D、非金属原子越容易得到电子,其单质还原性越强 |
下列化学用语书写正确的是( )
| A、氢气分子的电子式:H:H |
B、硫原子的结构示意图: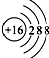 |
C、溴化钠的电子式: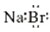 |
D、苯的分子式 |