题目内容
【题目】如图所示,两圆圈相交的阴影部分表示圆圈内的物质相互发生的反应。已知钠及其氧化物的物质的量均为0.1 mol,水的质量为100 g。下列说法不正确的是( )
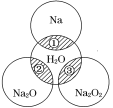
A.Na2O2中阴阳离子数目之比为1∶2
B.反应①的离子方程式为:Na+2H2O===Na++2OH-+H2↑
C.反应③最多能产生0.05 mol O2
D.①、②、③充分反应后所得溶液的质量分数从大到小:①>②>③
【答案】BD
【解析】
试题分析:A、根据过氧化钠的电子式为:![]() ,阴阳离子个数比为1:2,故说法正确;B、反应前后电荷不守恒,应是2Na+2H2O=2Na++2OH-+H2↑,故说法错误;C、反应③的反应方程式为2Na2O2 +2H2O=4NaOH+O2↑,因此消耗1molNa2O2产生氧气的物质的量为0.05molO2,故说法正确;D、反应后溶质是NaOH,其质量分别是:4g、8g、8g,溶液的质量分别是(0.1×23+100-0.05×2)g=102.2g、106.2g、(0.1×78+100-0.05×32)g=106.2g,因此②=③>①,故说法错误。
,阴阳离子个数比为1:2,故说法正确;B、反应前后电荷不守恒,应是2Na+2H2O=2Na++2OH-+H2↑,故说法错误;C、反应③的反应方程式为2Na2O2 +2H2O=4NaOH+O2↑,因此消耗1molNa2O2产生氧气的物质的量为0.05molO2,故说法正确;D、反应后溶质是NaOH,其质量分别是:4g、8g、8g,溶液的质量分别是(0.1×23+100-0.05×2)g=102.2g、106.2g、(0.1×78+100-0.05×32)g=106.2g,因此②=③>①,故说法错误。

练习册系列答案
相关题目
