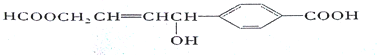题目内容
【题目】我国本土科学家屠呦呦因为发现青蒿素而获得2015年的诺贝尔生理和医学奖。己知二羟甲戊酸是生物合成青蒿素的原料之一,下列关于二羟甲戊酸的说法正确的是
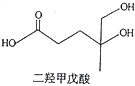
A. 与乙醇发生酯化反应生成产物的分子式为C8H18O4
B. 在铜的催化下与氧气反应的产物可以发生银镜反应
C. 标准状况下1mol该有机物可以与足量金属钠反应产生22.4L H2
D. 能发生加成反应,不能发生取代反应
【答案】B
【解析】A、二羟甲戊酸分子式为C6H12O4,与乙醇发生酯化反应增加C2H6O,减少1分子水,生成产物的分子式为C8H16O4,故A错误;B、5号碳上的羟基氧化成醛基,能发生银镜反应,故B正确;C、2个羟基和羧基均能与钠反应,标准状况下1mol该有机物可以与足量金属钠反应产生33.6L H2,故C错误;D、不能发生加成反应,能发生取代反应,故D错误;故选B。

练习册系列答案
相关题目