题目内容
某学生利用氯酸钾分解制氧气的反应,测定氧气的摩尔质量。实验步骤如下:


①检查装置气密性
②把适量的氯酸钾粉末和少量二氧化锰粉末混合均匀,放入干燥的试管中,准确称量,质量为ag。
③装好实验装置。
④加热,开始反应,直到产生一定量的气体
⑤停止加热,测量收集到气体的体积
⑥准确称量试管和残留物的质量为b g。
⑦测量实验室的温度。
⑧处理实验数据,求出氧气的摩尔质量。
回答下列问题:
(1)如何检查装置的气密性? 。
(2)以下是测量收集到气体体积必须包括的几个步骤:
①调整量筒内外液面高度使之相同;
②使试管和量筒内的气体都冷却至室温;
③读取量筒内气体的体积。
这三步操作的正确顺序是: (请填写步骤代号)。
(3)如果实验中得到的氧气体积是cL(25℃、1.0l×l05Pa,该条件下气体的摩尔体积为Vm).氧气的摩尔质量的计算式为(含a、b、c,不必化简):M(O2)= 。
 (4)若50mL量筒内液面如右图所示,则所测得气体的体积约为____________________mL.
(4)若50mL量筒内液面如右图所示,则所测得气体的体积约为____________________mL.
(5)若计算所得结果比实际值偏大,则可能的原因是___________
A.氯酸钾中混有不产生氧气的固体杂质
B.第一次称量时药品、砝码反置
C.药品未完全分解
D.量筒内液体被排尽
E.装置漏气
F.读数时俯视量筒刻度
⑴将导管末端伸入水中,用手捂住试管(或小心给试管加热),松开手(或停止加热)导管口有气泡产生,导管内形成一段稳定水柱,则气密性良好。(2分)
⑵②①③(2分)
⑶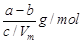 (3分)
(3分)
⑷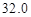 (2分)
⑸BDEF(3分)
(2分)
⑸BDEF(3分)
【解析】

 某学生利用氯酸钾分解制氧气的反应,测定氧气的摩尔质量.实验步骤如下:
某学生利用氯酸钾分解制氧气的反应,测定氧气的摩尔质量.实验步骤如下:

