题目内容
可逆反应N2+3H2 2NH3是工业上合成氨的重要反应。
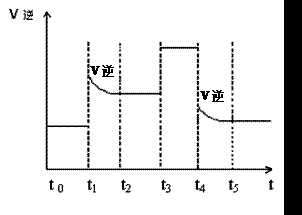
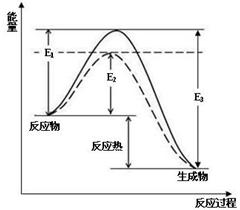
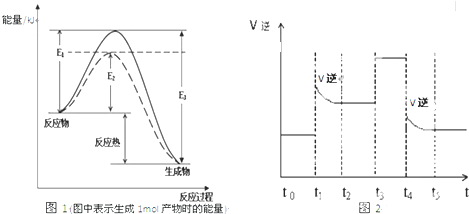
图1 (图中表示生成1mol物质时的能量) 图2
(1)根据图1请写出合成氨的热化学方程式 (热量用E1、E2或E3表示)
(2) 图1中虚线部分是通过改变化学反应中的 条件,请解释原因
(3)当反应达到平衡位置时不断改变条件(不改变N2、H2和NH3的量),图2表示反应速率与反应过程的关系,其中表示平衡混合物中NH3的含量最高的一段时间是
(4)在一定温度下,若将4a mol H2和2amol N2放入2L的密闭容器中,充分反应后测得N2的转化率为50%,则该反应的平衡常数为 。若此时再向该容器中投入a mol H2、amol N2和2amol NH3,判断平衡移动的方向是 (“正向移动”“ 逆向移动”或“不移动”)
(5)将上述实验中产生的NH3通入到0.04mol·L-1的FeCl3溶液中,要使溶液中Fe3+沉淀较完全(即Fe3+浓度降至原来的千分之一),则溶液的pH为 (已知常温下,Fe(OH)3的溶度积常数Ksp=4×10-38)
![]() (14分)(1) N2(g) +3H2(g) 2NH3(g) △H=2(E1-E3) (2分,没写物质状态不给分,其他答案合理给分,不写单位不扣分)
(14分)(1) N2(g) +3H2(g) 2NH3(g) △H=2(E1-E3) (2分,没写物质状态不给分,其他答案合理给分,不写单位不扣分)
(2) 催化剂(2分), 因为催化剂能改变反应的路径,使发生反应所需的活化能降低 (2分)
(3) t 0 – t1 (2分) (4) ![]() (2分) 正向移动 (2分) (5) 3 (2分)
(2分) 正向移动 (2分) (5) 3 (2分)
解析:

 中考解读考点精练系列答案
中考解读考点精练系列答案