题目内容
如图示向盛有0.2mol×L-150mL明矾溶液中,慢慢加入0.1mol×L-1Ba(OH)2溶液,生成沉淀的质量随着加入Ba(OH)2溶液的体积变化图像,当产生的沉淀量最大时(即B点)改加0.5mol×L-1HCl。沉淀总质量又发生变化(虚线部分)。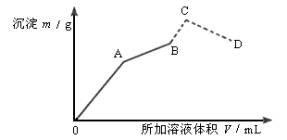
(1)写出A、B、C、D四点发生的化学方程式___________。
(2)计算A、B、C、D点所加入Ba(OH)2溶液,盐酸体积及沉淀质量并填入下表。
项目 A B C D
V[(Ba(OH)2)]/mL
V(HCl)/mL
M(沉淀)/g
解析:
| (1)2KAl(SO4)2+3Ba(OH)2=3BaSO4↓+2Al(OH)3↓+K2SO4
KAl(SO4)2+2Ba(OH)2=KAlO2+2BaSO4↓+2H2O KAlO2+HCl+H2O=Al(OH)3↓+KCl Al(OH)3+3HCl=AlO3+3H2O (2)
150 200 200 200 0 0 20 80 4.275 4.66 5.44 4.66
|
提示:
| 提示:(1)由图可知,A点时生成的沉淀是Al(OH)3和BaSO4,但质量不是最大,当Ba(OH)2加到B点时Ba2+全部转换成BaSO4,而Al3+先转变为Al(OH)3,后而转变为AlO2-,到B点转换完成,且此时沉淀量最大,再滴加盐酸时,AlO2-又转化为Al(OH)3。
(2)A点时,有 2KAl(SO4)2~3Ba(OH)2 ~ 3BaSO4 ~ 2Al(OH)3 2 3 3 2 0.2´0.05 VA´0.1 得VA= 即150mL Ba(OH)2溶液 得沉淀mA= B点时有 KAl(SO4)2~2Ba(OH)2~2BaSO4 1 2 2 0.2´0.05 0.1VB 2´0.2´0.05 VB=0.2L 即200mL Ba(OH)2溶液 mB=0.1´0.2´233g=4.66g C点时 KAlO2~HCl~Al(OH)3 1 1 1 0.2´0.05 0.5Vc 0.2´0.05 加入盐酸:Vc=0.02L 即20mL盐酸 mc=mB+0.2´0.05´78g=5.44g D点时:VD=Vc+3Vc=4Vc=80mL mD=mB=4.66g
|

 阅读快车系列答案
阅读快车系列答案