题目内容
有①甲烷,②乙烷,③丙烷,④丁烷4种烷烃,试回答下列问题:
(1)请写出烷烃(用通式表示)在足量的氧气中充分燃烧的化学方程式:
________________________________________________________________________。
(2)相同状况下,等体积的上述气态烃,消耗O2的量最多的是________ 。
(3)等质量的上述气态烃,在充分燃烧时,消耗O2的量最多的是________ 。
(4)存在同分异构体的是_______ _。
(5)在120 ℃,1.01×105Pa条件下,某气态烃与足量的O2完全反应后,测得反应前后气体的体积没有发生改变,则该烃为________ 。
(6)10 mL某气态烃,在50 mL O2中充分燃烧,得到液态水,以及体积为35 mL的混合气体(所有气体体积均在同温同压下测定)。该气态烃是________ 。
(共10分)(1)CnH2n+2+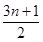 O2
O2  nCO2+(n+1)H2O(3分)
nCO2+(n+1)H2O(3分)
(2)丁烷(1分) (3)甲烷 (1分) (4)丁烷 (1分)
(5)甲烷(2分) (6)乙烷(2分)
【解析】
试题分析:(1)根据烷烃的通式nH2n+2可知,烷烃在足量的氧气中充分燃烧的化学方程式CnH2n+2+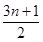 O2
O2  nCO2+(n+1)H2O。
nCO2+(n+1)H2O。
(2)烃燃烧的通式是CxHy+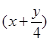 O2
O2  xCO2+
xCO2+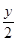 H2O,所以在相同状况下,等体积的上述气态烃,消耗O2的多少只与
H2O,所以在相同状况下,等体积的上述气态烃,消耗O2的多少只与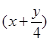 有关系,因此消耗氧气最多的是丁烷。
有关系,因此消耗氧气最多的是丁烷。
(3)在质量相等的条件下,烃燃烧消耗氧气的多少与烃分子中含碳量有关系。含碳量越低,消耗的氧气越少,含碳量越高,消耗的氧气越多,则等质量的上述气态烃,在充分燃烧时,消耗O2的量最多的是甲烷。
(4)存在同分异构体的是丁烷,有正丁烷和异丁烷两种同分异构体。
(5)在120 ℃,1.01×105Pa条件下,某气态烃与足量的O2完全反应后,测得反应前后气体的体积没有发生改变,这说明1+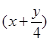 =x+
=x+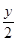 ,解得y=4,所以符合条件的是甲烷。
,解得y=4,所以符合条件的是甲烷。
(6)CxHy+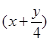 O2
O2  xCO2+
xCO2+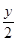 H2O △V↓
H2O △V↓
1 x+y/4 x 1+y/4
10 60-35=25
解得y=6,且满足10×(x+y/4)≤50
即x≤3.5
所以该有机物是乙烷
考点:考查烃分子燃烧的有关计算
点评:该题是中等难度的试题,试题针对性强,注重答题的灵活性。试题在注重对学生基础知识巩固和训练的同时,侧重对学生答题能力的培养,有利于培养学生的逻辑推理能力和规范答题能力。明确烃的燃烧通式,掌握烃燃烧计算的有关规律是解题的关键,注意知识的积累和总结。

 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案