题目内容
【题目】MnSO4晶体是一种易溶于水的微红色晶体,某校同学设计实验制备并检验MnSO4的性质。回答下列问题:
(1)甲组同学设计用SO2和适量纯净的MnO2制备MnSO4,其装置如下:
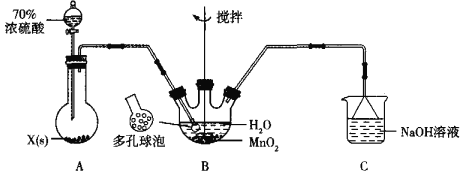
①A装置中固体药品X通常是______填化学式)。
②B装置中通SO2的导管末端接多孔球泡的目的是______;C装置用于吸收少量的SO2,发生反应的离子方程式为______。
(2)乙组同学定性检验甲组同学的产品中Mn2+的存在,取少量晶体溶于水,加入(NH4)2S2O8溶液,滴入硝酸银(作催化剂),微热振荡,溶液显紫色,发生反应的离子方程式为______。
(3)丙组同学为检验无水MnSO4(接近白色)的热分解产物,将MnSO4晶体脱水后放入下图所示的装置中,打开K1和K2,缓慢通入N2,加热,硬质玻璃管中最后得到黑色固体。
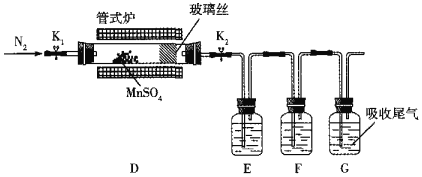
①检验分解的气态产物中是否有SO2及SO3,装置E、F中的溶液依次是______、______(填字母)。
a.Ba(NO3)2溶液b.BaCl2溶液c.品红溶液d.浓硫酸
②若D中得到的黑色粉末为Mn3O4,E、F中均有明显现象,则D中发生反应的化学方程式为______。
(4)丁组同学设计实验以丙组同学得到的黑色粉末为原料,利用铝热反应原理将其还原为金属锰,所需的药品除氯酸钾外,还需要______。
【答案】Na2SO3 增大SO2与液体的接触面积 SO2+2OH-=SO32-+H2O 2Mn2++5S2O82-+8H2O 2MnO4-+10SO42-+16H+ b c 3MnSO4
2MnO4-+10SO42-+16H+ b c 3MnSO4![]() Mn3O4+SO2↑+2SO3↑ 铝粉、镁条
Mn3O4+SO2↑+2SO3↑ 铝粉、镁条
【解析】
(1)①A装置制备二氧化硫气体,实验室一般用亚硫酸盐与浓硫酸制备,固体药品X通常是Na2SO3,故答案为:Na2SO3;
②B装置中通SO2的导管末端接多孔球泡的目的是增大SO2与液体的接触面积;C装置用于吸收少量的SO2,反应为:SO2+2OH-=SO32-+H2O,故答案为:增大SO2与液体的接触面积;SO2+2OH-=SO32-+H2O;
(2)根据题意,Mn2+与(NH4)2S2O8溶液在硝酸银作催化剂,微热振荡反应,溶液显紫色,说明生成高锰酸跟离子,锰元素化合价升高,则硫元素化合价降低生成硫酸根离子,故反应为:2Mn2++5S2O82-+8H2O![]() 2MnO4-+10SO42-+16H+,故答案为:2Mn2++5S2O82-+8H2O
2MnO4-+10SO42-+16H+,故答案为:2Mn2++5S2O82-+8H2O![]() 2MnO4-+10SO42-+16H+;
2MnO4-+10SO42-+16H+;
(3)①检验分解的气态产物中是否有SO2及SO3,检验三氧化硫时,为防止二氧化硫的干扰,用氯化钡溶液检验,二氧化硫用品红溶液检验,装置E、F中的溶液依次是BaCl2溶液,品红溶液,故答案为:b;c;
②D中得到的黑色粉末为Mn3O4,E、F中均有明显现象,说明生成SO2及SO3,反应为:3MnSO4![]() Mn3O4+SO2↑+2SO3↑,故答案为:3MnSO4
Mn3O4+SO2↑+2SO3↑,故答案为:3MnSO4![]() Mn3O4+SO2↑+2SO3↑;
Mn3O4+SO2↑+2SO3↑;
(4)利用铝热反应原理将其还原为金属锰,所需的药品有铝粉,氯酸钾作供氧剂,还需要点燃的镁条提供高温条件,故答案为:铝粉、镁条。