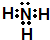题目内容
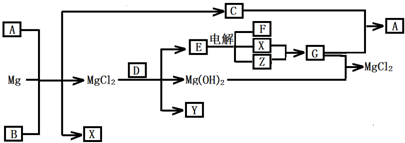
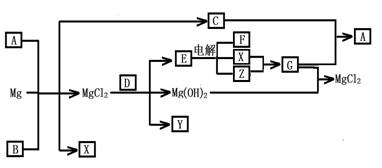
Mg及其化合物可以发生如下转化(部分反应物、生成物或水已略去),已知X、Y、Z为气态单质,B常温下为液态,D为化合物,它的焰色反应为黄色,C和G混合冒白烟并生成A
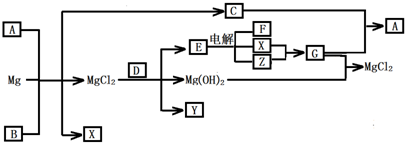
(1)写出下列物质的化学式:A______ Y______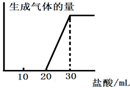
(2)写出C的电子式______
(3)写出MgCl2与D反应的化学方程式______
(4)请用电离或水解平衡解释A+B+Mg→C+X+MgCl2的原因______.
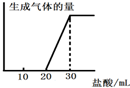
(5)将1molCO2通入1L溶质为F的溶液中,充分反应后,再向混合液中逐滴滴加盐酸,所加盐酸的体积与生成的气体的关系如图所示则原F溶液的浓度为______mol/L.
解:本题的题眼是C和G混合冒白烟并生成A,G与氢氧化镁反应生成氯化镁,则G为氯化氢,判断XY为氢气和氯气;从而推断C为碱性气体NH3,A为NH4Cl;D的焰色反应为黄色,说明含有钠元素,能和氯化镁反应生成氢氧化镁、单质气体Y、和能电解的化合物E,结合XY为氢气和氯气可知E为NaCl;所以能和氯化镁生成碱和气体的含钠化合物只能是过氧化钠,推断D为过氧化钠,Y为氧气,金属镁和A氯化铵反应生成氯化镁、氢气、和氨气,判断B为水,综合分析判断转化关系中的各种物质为:
A、NH4Cl;B、H2O;C、NH3;D、Na2O2;E、NaCl;F、NaOH;G、HCl;X、H2;Y、O2;Z、Cl2;依据判断出的各物质及性质回答各步问题:
(1)依据上述推断可知A为NH4Cl,Y为O2,故答案为:NH4Cl;O2;
(2)推断C为氨气所以电子式为 ,故答案为:
,故答案为: ;
;
(3)氯化镁与D过氧化钠反应的化学方程式结合生成产物为氢氧化镁、氧气、氯化钠,根据书写化学方程式的要求配平写出:2MgCl2+2Na2O2+2H2O=4NaCl+2Mg(OH)2↓+O2↑,
故答案为:2MgCl2+2Na2O2+2H2O=4NaCl+2Mg(OH)2↓+O2↑;
(4)A+B+Mg→C+X+MgCl2的化学方程式为,2NH4Cl+Mg=2NH3↑+H2↑+MgCl2,NH4Cl水解生成NH3?H2O和HCl,加入镁后,因为镁非常活泼,与水解所得盐酸反应生成H2,使溶液中氢离子的浓度减小,从而促进了NH4Cl的水解,反应放出热量最终逸出NH3,
故答案为:NH4Cl水解生成NH3?H2O和HCl,加入镁后,因为镁非常活泼,与水解所得盐酸反应生成H2,使溶液中氢离子的浓度减小,从而促进了NH4Cl的水解,最终逸出NH3;
(5)F溶液为氢氧化钠溶液,通入1mol二氧化碳气体反应后,滴入盐酸开始无气体生成,最后有气体生成到不变.过程中发生的化学反应为:CO2+2NaOH=Na2CO3+H2O;由图象分析可知,消耗20ml盐酸无气体放出,说明 二氧化碳与氢氧化钠反应生成的产物中无碳酸氢钠,滴入盐酸发生反应OH-+H+=H2O CO32-+H+=HCO3- HCO3-+H+=CO2↑+H2O,图象中的数据显示,生成二氧化碳消耗的氯化氢与碳酸钠生成碳酸氢钠消耗的氯化氢相同,所以原溶液中剩余氢氧化钠,剩余的氢氧化钠需要10ml的盐酸中和,根据碳元素守恒,二氧化碳气体物质的量为1mol,和氢氧化钠反应生成碳酸钠为1mol,生成碳酸氢钠为1mol,消耗氯化氢1mol;根据反应可知最后放出二氧化碳1mol,消耗氯化氢1mol,依据盐酸消耗的体积分析判断,原氢氧化钠溶液剩余1mol氢氧化钠,因此元氢氧化钠溶液中共含有氢氧化钠为3mol,浓度为3mol/L,
故答案为:0.3mol/L.
分析:依据题干信息结合转化关系结合信息可知,X、Y、Z为气态单质,B常温下为液态可以分析判断为水,D为化合物,它的焰色反应为黄色说明含有钠元素,含钠的化合物与氯化镁反应生成了氢氧化镁,说明D在反应时生成了碱沉淀镁离子,同时生成单质气体Y,E中含有钠元素电解生成XZ气体和F,G和氢氧化镁反应生成氯化镁,证明G为盐酸,所以XY为氢气和氯气,结合条件判断E为氯化钠;含钠的化合物与氯化镁反应生成氯化钠氢氧化镁和单质气体Y,只有D为过氧化钠符合,所以Y为氧气;C和G混合冒白烟并生成A,结合G为氯化氢可知C应为碱性气体氨气,A为氯化铵,金属镁与氯化铵水溶液水解生成的氢离子发生反应,生成氯化镁、氢气,促进了氯化铵的水解进行,反应放热同时生成了氨气,综合现象和转化关系进行推断检查;依据化学方程式的计算完成F溶液浓度的计算.
点评:本题考查了元素化合物的相互转化关系,综合性较强难度较大,注意分析转化过程中的特征反应,特征现象的应用,充分利用题干信息进行综合推断.
A、NH4Cl;B、H2O;C、NH3;D、Na2O2;E、NaCl;F、NaOH;G、HCl;X、H2;Y、O2;Z、Cl2;依据判断出的各物质及性质回答各步问题:
(1)依据上述推断可知A为NH4Cl,Y为O2,故答案为:NH4Cl;O2;
(2)推断C为氨气所以电子式为
 ,故答案为:
,故答案为: ;
;(3)氯化镁与D过氧化钠反应的化学方程式结合生成产物为氢氧化镁、氧气、氯化钠,根据书写化学方程式的要求配平写出:2MgCl2+2Na2O2+2H2O=4NaCl+2Mg(OH)2↓+O2↑,
故答案为:2MgCl2+2Na2O2+2H2O=4NaCl+2Mg(OH)2↓+O2↑;
(4)A+B+Mg→C+X+MgCl2的化学方程式为,2NH4Cl+Mg=2NH3↑+H2↑+MgCl2,NH4Cl水解生成NH3?H2O和HCl,加入镁后,因为镁非常活泼,与水解所得盐酸反应生成H2,使溶液中氢离子的浓度减小,从而促进了NH4Cl的水解,反应放出热量最终逸出NH3,
故答案为:NH4Cl水解生成NH3?H2O和HCl,加入镁后,因为镁非常活泼,与水解所得盐酸反应生成H2,使溶液中氢离子的浓度减小,从而促进了NH4Cl的水解,最终逸出NH3;
(5)F溶液为氢氧化钠溶液,通入1mol二氧化碳气体反应后,滴入盐酸开始无气体生成,最后有气体生成到不变.过程中发生的化学反应为:CO2+2NaOH=Na2CO3+H2O;由图象分析可知,消耗20ml盐酸无气体放出,说明 二氧化碳与氢氧化钠反应生成的产物中无碳酸氢钠,滴入盐酸发生反应OH-+H+=H2O CO32-+H+=HCO3- HCO3-+H+=CO2↑+H2O,图象中的数据显示,生成二氧化碳消耗的氯化氢与碳酸钠生成碳酸氢钠消耗的氯化氢相同,所以原溶液中剩余氢氧化钠,剩余的氢氧化钠需要10ml的盐酸中和,根据碳元素守恒,二氧化碳气体物质的量为1mol,和氢氧化钠反应生成碳酸钠为1mol,生成碳酸氢钠为1mol,消耗氯化氢1mol;根据反应可知最后放出二氧化碳1mol,消耗氯化氢1mol,依据盐酸消耗的体积分析判断,原氢氧化钠溶液剩余1mol氢氧化钠,因此元氢氧化钠溶液中共含有氢氧化钠为3mol,浓度为3mol/L,
故答案为:0.3mol/L.
分析:依据题干信息结合转化关系结合信息可知,X、Y、Z为气态单质,B常温下为液态可以分析判断为水,D为化合物,它的焰色反应为黄色说明含有钠元素,含钠的化合物与氯化镁反应生成了氢氧化镁,说明D在反应时生成了碱沉淀镁离子,同时生成单质气体Y,E中含有钠元素电解生成XZ气体和F,G和氢氧化镁反应生成氯化镁,证明G为盐酸,所以XY为氢气和氯气,结合条件判断E为氯化钠;含钠的化合物与氯化镁反应生成氯化钠氢氧化镁和单质气体Y,只有D为过氧化钠符合,所以Y为氧气;C和G混合冒白烟并生成A,结合G为氯化氢可知C应为碱性气体氨气,A为氯化铵,金属镁与氯化铵水溶液水解生成的氢离子发生反应,生成氯化镁、氢气,促进了氯化铵的水解进行,反应放热同时生成了氨气,综合现象和转化关系进行推断检查;依据化学方程式的计算完成F溶液浓度的计算.
点评:本题考查了元素化合物的相互转化关系,综合性较强难度较大,注意分析转化过程中的特征反应,特征现象的应用,充分利用题干信息进行综合推断.

练习册系列答案
相关题目