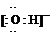题目内容
(12分)在密闭容器中,保持一定温度进行如下反应N2(g)+3H2(g)![]() 2NH3(g), 已知加入1 mol N2和3 mol H2,在恒压条件下达到平衡时生成a mol NH3,在恒容条件下达到平衡时生成b mol NH3(见下表中编号①的一行)。若相同条件下,达到平衡时混合物中各组分的百分含量不变。回答下列问题:
2NH3(g), 已知加入1 mol N2和3 mol H2,在恒压条件下达到平衡时生成a mol NH3,在恒容条件下达到平衡时生成b mol NH3(见下表中编号①的一行)。若相同条件下,达到平衡时混合物中各组分的百分含量不变。回答下列问题:
(1)写出该反应的化学平衡常数表达式:K=___________。
(2)平衡常数K值越大,表明建立平衡时___________(填字母序号)。
A.N2的转化率越高 B.NH3的产量越大
C.正反应进行得越彻底 D.化学反应速度越快
(3)a与b的关系是:a b(填>、<、=)
(4)填写下表:
| 状态 条件 | 起始时物质的物质的量(mol) | 平衡时NH3的物质的量 (mol) | |||
| 编号 | X(N2) | Y(H2) | Z(NH3) | ||
| 恒容 | ① | 1 | 3 | 0 | b |
| ② | 0 | 0 | b | ||
| ③ | 2.25 | b | |||
答案(12分)每格2分]
(1)c2(NH3)/c(N2)·c3(H2) (2)A、C (3)>
(4)


练习册系列答案
相关题目
 X、Y、Z、W为含有相同电子数的分子或离子,均由原子序数小于10的元素组成.X有5个原子核.通常状况下,W为无色液体.已知:X+Y
X、Y、Z、W为含有相同电子数的分子或离子,均由原子序数小于10的元素组成.X有5个原子核.通常状况下,W为无色液体.已知:X+Y