题目内容
【题目】向X的溶液中,加入Y试剂,产生的沉淀或气体如图所示与所述情形相符的是( ) 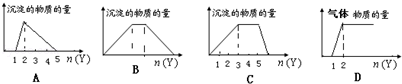
A.向HCl和AlCl3的混合液中滴加NaOH
B.向NaOH和Ca(OH)2的混合液中通入CO2
C.向NH4Al(SO4)2溶液中滴加NaOH
D.向NaOH和Na2CO3的混合液中滴加稀HCl
【答案】B
【解析】解:A、因向HCl和AlCl3的混合液中滴加NaOH时,先发生HCl+NaOH═NaCl+H2O,再发生Al3++3OH﹣═Al(OH)3↓、Al(OH)3+OH﹣═AlO2﹣+2H2O,生成沉淀与沉淀溶解消耗的碱的物质的量之比为3:1,图象与发生的化学反应不符,故A错误; B、因向NaOH和Ca(OH)2的混合液中通入CO2 , 先发生Ca(OH)2+CO2═CaCO3↓+H2O,再发生CO2+NaOH═NaHCO3 , 最后发生CaCO3↓+H2O+CO2═Ca(HCO3)2 , 图象与反应符合,故B正确;
C、向NH4Al(SO4)2溶液中滴加NaOH,先发生Al3++3OH﹣═Al(OH)3↓,再发生NH4++OH﹣═NH3 . H2O,最后发生Al(OH)3+OH﹣═AlO2﹣+2H2O,铵根离子消耗的碱与氢氧化铝消耗的碱应为1:1,图象中横坐标中的量与化学反应不符,故C错误;
D、向NaOH和Na2CO3的混合液中滴加稀HCl,先发生HCl+NaOH═NaCl+H2O,再发生Na2CO3+HCl═NaHCO3+NaCl,最后发生NaHCO3+HCl═NaCl+CO2↑+H2O,未生成气体时消耗的酸与生成气体时消耗的酸的物质的量应大于1:1,而图象中为1:1,则图象与发生的化学反应不符,故D错误;
故选B.

【题目】反应的平衡常数表达式为K=![]() ,在不同的温度下该反应的平衡常数如下表所示:
,在不同的温度下该反应的平衡常数如下表所示:
t/℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 1.67 | 1.11 | 1.00 | 0.60 | 0.38 |
下列有关叙述不正确的是( )
A. 该反应的化学方程式是CO(g)+H2O(g)![]() CO2(g)+H2(g)
CO2(g)+H2(g)
B. 上述反应的正反应是放热反应
C. 如果在一定体积的密闭容器中加入CO2和H2各1mol,5 min后温度升高到830 ℃,此时测得CO2为0.4 mol时,该反应达到平衡状态
D. 某温度下,如果平衡浓度符合下列关系式: ![]() =
=![]() ,判断此时的温度是1000℃
,判断此时的温度是1000℃
【题目】我国从国外进口某原料经测定主要含有A、B、C、D、E五种前四周期元素,且原子序数依次增大。元素A、B、C、D、E的原子结构等信息如下:
元素 | 元素性质或原子结构 |
A | 周期表中原子半径最小的元素 |
B | 原子核外有三种不同的能级且各个能级所填充的电子数相同 |
C | 最外层p轨道半充满 |
D | 位于短周期,其原子的核外成对电子数是未成对电子数的3倍 |
E | 位于ds区且原子的最外层电子数与A的相同 |
请回答下列问题(用A、B、C、D、E所对应的元素符号作答):
(1)B、C、D第一电离能由小到大为______________。
(2)E的二价离子的电子排布式为_____________。
(3)A2B2D4常用作除锈剂,该分子中B的杂化方式为_____________;1 mol A2B2D4分子中含有σ键数目为_____________。
(4)与化合物BD互为等电子体的阴离子化学式为___________ (任写一种)。
(5)B2A6、C2A4分子中均含有18个电子,它们的沸点相差较大,主要原因是_______________。
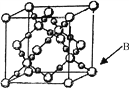
(6)BD2在高温高压下所形成晶体的晶胞如图所示。一个该晶胞中含___________个D原子。