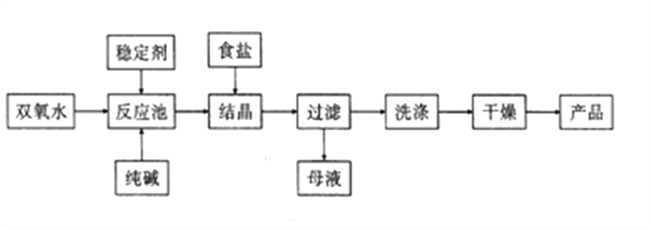
��Ŀ����
����Ŀ����ijNaCl��Һ��Ʒ�к���Na2SO4��CaCl2����(����Һ��X��ʾ)����ȥ���ʵ�ʵ�鷽��������
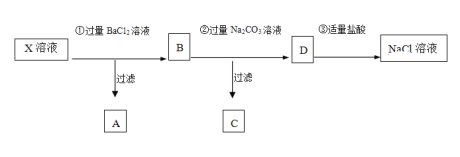
(1)B��Һ�д��ڵ���������_________����������_________��
(2)C���������ʵĻ�ѧʽ��_________��
(3)D�м�����������������ٵ�����__________��
(4)�ٺ͢ڲ��ܵ���˳���������__________��
(5)ijͬѧ��Ϊ�ɽ��Ϸ������иĽ����ټ������BaCO3 �ڼ����������ᣬ���ɴﵽ���ӵ�Ŀ�ģ����Ҳ����Ϊ��㡣���������ַ����Ƿ���ȷ______��˵������_________��
���𰸡�Na����Ba2+��Ca2+ Cl- CaCO3 BaCO3 CO32- �ٺ͢ڵ���˳����ȻҲ���Գ�ȥCa2+ ��SO42-�����Ǻ�����BaCl2��Һ�е�Ba2+�����ʵ���ʽ������Һ�У�δ��ȥ ����ȷ ��ΪBaCO3������ˮ����Na2SO4��CaCl2���Է�����Ӧ���������ȥ���ʵ�Ŀ��
��������
ijNaCl��Һ��Ʒ�к���Na2SO4��CaCl2���ʣ�����BaCl2������BaSO4��ɫ���������˺���ҺB�к���NaCl ��CaCl2 ��BaCl2�ɷ֣��ټ��������Na2CO3���ɳ���CΪBaCO3��CaCO3�����˺���ҺD����NaCl ��Na2CO3���ټ�������HCl��Һ����Һ��ΪNaCl��
(1)�ۺ���������֪: B�к���NaCl ��CaCl2 ��BaCl2�ɷ֣�����B��Һ�д��ڵ���������Na����Ba2+��Ca2+����������Cl-���𰸣�Na����Ba2+��Ca2+ ��Cl-��
(2) �ۺ���������֪: ���������Na2CO3���ɳ���CΪBaCO3��CaCO3������C�к��к��е����ʵĻ�ѧʽ����CaCO3 ��BaCO3���𰸣�CaCO3 ��BaCO3��
(3) �ۺ���������֪D����NaCl ��Na2CO3���������������2H++ CO32-=H2O+CO2![]() ,�������ٵ�����CO32-���𰸣�CO32-��
,�������ٵ�����CO32-���𰸣�CO32-��
(4) ����������˳����ȻҲ���Գ�ȥCa2+ ��SO42-�����Ǻ�����BaCl2��Һ�е�Ba2+�����ʵ���ʽ������Һ�У����ܳ�ȥ�������������ܵ�������: ����������˳����ȻҲ���Գ�ȥCa2+ ��SO42-�����Ǻ�����BaCl2��Һ�е�Ba2+�����ʵ���ʽ������Һ�У�δ��ȥ��
(5)��ͬѧ�ĸĽ���������������ΪBaCO3������ˮ����Na2SO4��CaCl2���Է�����Ӧ���������ȥ���ʵ�Ŀ�����𰸣�����ȷ����ΪBaCO3������ˮ����Na2SO4��CaCl2���Է�����Ӧ���������ȥ���ʵ�Ŀ����