题目内容
有三种金属单质A、B、C,其中A 的焰色反应为黄色,B、C是常见金属.三种金属单质A、B、C能与气体甲、乙、丙及物质D、E、F、G、H 之间发生如下转化关系(图中有些反应的产物和反应的条件没有全部标出):

请根据以上信息回答下列问题:
(1)写出下列物质的化学式:
A ;H ;丙 .
(2)写出下列反应的化学方程式:
反应① ;
反应② ;
反应③ .

请根据以上信息回答下列问题:
(1)写出下列物质的化学式:
A
(2)写出下列反应的化学方程式:
反应①
反应②
反应③
考点:无机物的推断
专题:推断题
分析:金属A焰色反应为黄色,故A为金属Na,与水反应生成NaOH与氢气,则D为NaOH,气体甲为H2;氢氧化钠与金属B反应生成氢气,故金属B为Al.黄绿色气体乙为Cl2,与氢气反应生成丙为HCl,HCl溶于水得物质E为盐酸.氢氧化钠与物质G反应生成红褐色沉淀H是Fe(OH)3,故物质G中含有Fe3+,由转化关系HCl和C反应生成F,F和氯气反应生成物质G,可知金属C为Fe,物质F为FeCl2,物质G为FeCl3,结合物质的性质解答该题.
解答:
解:金属A焰色反应为黄色,故A为金属Na,与水反应生成NaOH与氢气,则D为NaOH,气体甲为H2;氢氧化钠与金属B反应生成氢气,故金属B为Al.黄绿色气体乙为Cl2,与氢气反应生成丙为HCl,HCl溶于水得物质E为盐酸.氢氧化钠与物质G反应生成红褐色沉淀H是Fe(OH)3,故物质G中含有Fe3+,由转化关系HCl和C反应生成F,F和氯气反应生成物质G,可知金属C为Fe,物质F为FeCl2,物质G为FeCl3,
(1)通过以上分析知,A为Na,H为Fe(OH)3,丙为HCl,故答案为:Na;Fe(OH)3;HCl;
(2)①是Fe与盐酸反应生成氯化亚铁与氢气,反应方程式为:Fe+2HCl═FeCl2+H2↑;
反应②是Al与NaOH溶液反应生成偏铝酸钠与氢气,反应方程式为:2Al+2NaOH+2H2O═2NaAlO2+3H2↑,
③为氯气和氯化亚铁发生氧化还原反应生成氯化铁,反应方程式为Cl2+2FeCl2=2FeCl3,
故答案为:Fe+2HCl═FeCl2+H2↑;2Al+2NaOH+2H2O═2NaAlO2+3H2↑;Cl2+2FeCl2=2FeCl3.
(1)通过以上分析知,A为Na,H为Fe(OH)3,丙为HCl,故答案为:Na;Fe(OH)3;HCl;
(2)①是Fe与盐酸反应生成氯化亚铁与氢气,反应方程式为:Fe+2HCl═FeCl2+H2↑;
反应②是Al与NaOH溶液反应生成偏铝酸钠与氢气,反应方程式为:2Al+2NaOH+2H2O═2NaAlO2+3H2↑,
③为氯气和氯化亚铁发生氧化还原反应生成氯化铁,反应方程式为Cl2+2FeCl2=2FeCl3,
故答案为:Fe+2HCl═FeCl2+H2↑;2Al+2NaOH+2H2O═2NaAlO2+3H2↑;Cl2+2FeCl2=2FeCl3.
点评:本题考查了无机物推断,根据物质的特殊颜色、焰色反应等知识点采用正逆结合的方法进行推断,知道元素化合物知识,明确物质的性质,题目难度中等.

练习册系列答案
 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案
相关题目
下列各对物质中属于同分异构体的是( )
| A、金刚石与石墨 |
| B、红磷与白磷 |
| C、正戊烷与新戊烷 |
| D、氧气与臭氧 |
下列物质不属于烃的衍生物的是( )
A、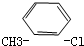 |
| B、CH3CH2-NO2 |
| C、CH2CH2Br |
| D、[CH2-CH2]n |
能大量共存于同一溶液中的离子组是( )
| A、N03-、HC03-、H+ |
| B、Na+、N03-、Cl- |
| C、H+、K+、OH- |
| D、S042-、Na+、Ba2+ |
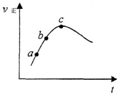 向绝热恒容密闭容器中通入气体A和B,一定条件下:A(g)+B(g)?C(g)+D(g)△H=QkJ/mol达到平衡,其正反应速率随时间变化的示意图如图所示.下列说法正确的是( )
向绝热恒容密闭容器中通入气体A和B,一定条件下:A(g)+B(g)?C(g)+D(g)△H=QkJ/mol达到平衡,其正反应速率随时间变化的示意图如图所示.下列说法正确的是( )| A、反应体系中加入催化剂,反应速率增大,△H也增大 |
| B、反应物的浓度:a点小于b点 |
| C、反应在C点达到到平衡 |
| D、达到平衡后,想办法升温,A的转化率将减小 |
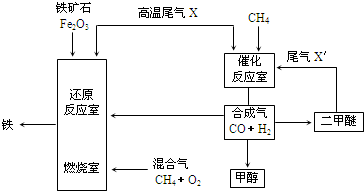
 B.
B. C.
C.
 E.
E. F.2-甲基丁烷和2,2-二甲基丙烷
F.2-甲基丁烷和2,2-二甲基丙烷
 (1)弱酸HA的电离常数 K=
(1)弱酸HA的电离常数 K=