题目内容
13.设NA为阿伏加德罗常数的值,下列叙述错误的是( )| A. | 含16 g氧原子的二氧化碳分子中含有的δ键数目为NA | |
| B. | 3.9 g Na2O2晶体中含有0.15NA个离子 | |
| C. | 常温常压下,5 g D2O含有的质子数、电子数、中子数均为2.5NA | |
| D. | 2 mol SO2和1 mol O2在一定条件下反应所得混合气体分子数小于2NA |
分析 A.含16 g氧原子的二氧化碳分子物质的量为$\frac{16g}{16g/mol}$×$\frac{1}{2}$=0.5mol,然后根据1mol二氧化碳中含2molC-O δ键来分析;
B.3.9 g Na2O2晶体物质的量=$\frac{3.9g}{78g/mol}$=0.05mol,1mol过氧化钠含2mol钠离子和1mol过氧根离子;
C.5 g D2O物质的量=$\frac{5g}{20g/mol}$=0.25mol,D2O含有的质子数10、电子数10、中子数=(2-1)×2+16-8=10;
D.二氧化硫和氧气反应为可逆反应,不能进行彻底.
解答 解:A.含16 g氧原子的二氧化碳的物质的量为$\frac{16g}{16g/mol}$×$\frac{1}{2}$=0.5mol=0.5mol,根据1mol二氧化碳中含2molC-Oδ键可知,0.5mol二氧化硅晶体中含有的δ键数目为NA,故A正确;
B.3.9 g Na2O2晶体物质的量=$\frac{3.9g}{78g/mol}$=0.05mol,1mol过氧化钠含2mol钠离子和1mol过氧根离子,则含有离子=0.05mol×3×NA=0.15NA个,故B正确;
C..5 g D2O物质的量=$\frac{5g}{20g/mol}$=0.25mol,1个D2O含有的质子数10、电子数10、中子数=(2-1)×2+16-8=10,则0.25mol含有的质子数、电子数、中子数均为2.5NA,故C正确;
D.2 mol SO2和1 mol O2在一定条件下反应,根据反应方程式2SO2+O2?2SO3可知,所得混合气体的物质的量大于2mol小于3mol,即混合气体分子数大于2NA,故D错误;
故选AD.
点评 本题考查了阿伏伽德罗常数的有关计算,掌握物质的量的计算公式和物质结构是解题关键,答题时注意物质结构的分析及可逆反应的分析,题目难度不大.

 课课优能力培优100分系列答案
课课优能力培优100分系列答案 优百分课时互动系列答案
优百分课时互动系列答案| A. | CH2═CH2+HCl→CH3CH2Cl | B. |  | ||
| C. |  | D. | 2CH3CH2OH+2Na→2CH3CH2ONa+H2↑ |
(1)若剩余的4.80g固体全是MnO2,则原混合物中KClO3的质量为11.80g;
(2)若剩余的4.80g固体是MnO2和KCl的混合物
①则25℃时KCl的溶解度为35g/100g水;
②原混合物中KClO3的质量为12.25g;
(3)MnO2是一种典型的强氧化剂,无论在实验室还是在化工生产中都有重要的应用.如下图是实验室制备氯气并进行一系列相关实验的装置(夹持设备和加热装置已略).

①制备氯气选用的药品为MnO2和浓盐酸,相应的离子方程式为MnO2+4H++2Cl-═Mn2++Cl2↑+2H2O.
②装置B的作用是除杂和安全瓶.实验进行时C中可能发生堵塞,请写出发生堵塞时B中的现象:锥形瓶中的液面下降,长颈漏斗中的液面上升.
③装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ依次放入c(选“a”“b”或“c”).
| a | b | c | |
| Ⅰ | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
| Ⅱ | 碱石灰 | 浓硫酸 | 无水氯化钙 |
| Ⅲ | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |

| A. | 点①时:c(CN-)>c(Na+)>c(HCN)>c(OH-) | |
| B. | 点③时:c(Na+)=c(CH3COO-)>c(H+) | |
| C. | 点④时:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) | |
| D. | 点①和点②所示溶液中:c(CH3COO-)-c(CN-)=c(HCN)-c(CH3COOH) |
 某品牌的家用消毒剂的有效成分为对氯间二甲苯酚(其结构简式如图所示),可以杀灭常见的病毒与细菌.下列有关该物质的说法正确的是( )
某品牌的家用消毒剂的有效成分为对氯间二甲苯酚(其结构简式如图所示),可以杀灭常见的病毒与细菌.下列有关该物质的说法正确的是( )| A. | 该物质的分子式为C8H10ClO | |
| B. | 1mol该物质最多可以与2molNaOH反应 | |
| C. | 1mol该物质可以与2molBr2发生取代反应 | |
| D. | 该物质能与FeCl3溶液反应生成紫色沉淀 |
| A. |  | B. |  | C. |  | D. |  |
| A. | 乙醇和水 | B. | 乙酸乙酯和乙酸 | C. | 溴乙烷和乙醇 | D. | 三氯甲烷和水 |
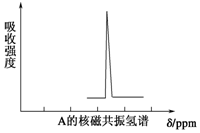 有一种新合成的高度对称的有机物A.已知10.4g A在足量O2中充分燃烧,将生成的混合气体依次通过足量的浓硫酸和碱石灰,分别增重7.2g和35.2g,经检验剩余气体为O2.
有一种新合成的高度对称的有机物A.已知10.4g A在足量O2中充分燃烧,将生成的混合气体依次通过足量的浓硫酸和碱石灰,分别增重7.2g和35.2g,经检验剩余气体为O2.
 ,其核磁共振氢谱有5个吸收峰.
,其核磁共振氢谱有5个吸收峰. 回答下列问题:
回答下列问题: