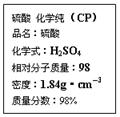
题目内容
0.6mol·L-1Fe2(SO4)3和1.2mol·L-1CuSO4的混合溶液200mL,加入一定量铁粉充分反应后,测得溶液中Fe2+与Cu2+物质的量之比为2 :1,则加入铁粉的物质的量为
| A.0.16mol | B.0.22mol | C.0.30mol | D.0.48mol |
A
试题分析:溶液中有Fe3+和Cu2+,铁粉先还原Fe3+,再还原Cu2+;溶液中Cu2+物质的量为1.2mol·L-1×0.2L=0.24mol,则Fe3+的物质的量为0.6mol·L-1×2×0.2L=0.24mol。由2 Fe3++Fe= 3Fe2+可知,Fe3+被完全还原,消耗了0.12mol的Fe,并生成了0.36mol的Fe2+。设与Cu2+反应的Fe的物质的量为xmol,则 = ,解得x=0.04。所以加入铁粉总的物质的量为0.16mol,选A。
点评:氧化还原反应是高考的必考内容,考生应把握以下两点:一、判断一个反应是否属于氧化还原反应,以及氧化剂(产物)、还原剂(产物)分别是什么;二、利用得失电子配平所给化学反应,并能进行简单的有关于电子守恒的计算。

练习册系列答案
相关题目