题目内容
羟基磷灰石〔Ca5(PO4)3OH〕是一种重要的生物无机材料,其常用的制备方法有两种:方法A:用浓氨水分别调Ca(NO3)2和(NH4)2HPO4溶液的pH约为12;在剧烈搅拌下,将(NH4)2HPO4溶液缓慢滴入Ca(NO3)2溶液中。
方法B:剧烈搅拌下,将H3PO4溶液缓慢滴加到Ca(OH)2悬浊液中。
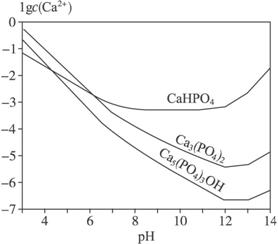
3种钙盐的溶解度随溶液pH的变化如上图所示(图中纵坐标是钙离子浓度的对数),回答下列问题:
(1)完成方法A和方法B中制备Ca5(PO4)3OH的化学反应方程式
①5Ca(NO3)2+3(NH4)2HPO4+4NH3·H2O====Ca5(PO4)3OH↓+________+________
②5Ca(OH)2+3H3PO4====______________________________________________
(2)与方法A相比,方法B的优点是_____________________________________。
(3)方法B中,如果H3PO4溶液滴加过快,制得的产物不纯,其原因是__________________。
(4)图中所示3种钙盐在人体中最稳定的存在形式是_______________________(填化学式)。
(5)糖黏附在牙齿上,在酶的作用下产生酸性物质,易造成龋齿,结合化学平衡移动原理,分析其原因_________________________。
(1)①10NH4NO3 3H2O
②Ca5(PO4)3OH↓+9H2O
(2)唯一副产物是水,工艺简单
(3)反应液局部酸性过大,会有CaHPO4产生
(4)Ca5(PO4)3OH
(5)酸性物质使沉淀溶解平衡
Ca5(PO4)3OH(s)![]() 5Ca2+(aq)+3
5Ca2+(aq)+3![]() (aq)+OH-(aq)向右移动,导致Ca5(PO4)3OH溶解,造成龋齿
(aq)+OH-(aq)向右移动,导致Ca5(PO4)3OH溶解,造成龋齿
解析:考查学生对难溶电解质的溶解平衡和酸碱反应的了解;考查学生书写化学反应方程式的能力,读图解析和方案评价能力,以及化学平衡知识的综合应用能力。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案