题目内容
【题目】工业上采用软锰矿(主要成分为MnO2)来制取硫酸锰,工艺流程如下:
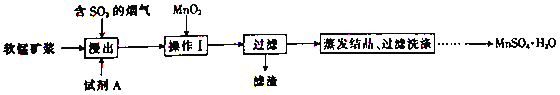
已知:浸出液中的金属离子主要是Mn2+,还含有少量的Fe2+。回答下列问题:
(1)实验室进行过滤操作时用到的玻璃仪器有玻璃棒、烧杯和______。
(2)浸出后,锰主要以Mn2+的形式存在,写出MnO2与SO2反应的离子方程式:____________。
(3)浸出过程的副反应之一是部分SO2被氧化为硫酸,致使浸出液的pH下降,这将不利于软锰矿浆继续吸收SO2。欲消除生成的硫酸,可选用的试剂A是______(填字母)。
A.MnCO3 B.MnO2 C.Mn(OH)2 D.MnSO4
(4)操作I的目的是__________和调节溶液的pH至3~4。检验过滤后的滤液中是否含有Fe3+的操作是_______________。
【答案】 漏斗 MnO2+SO2 =Mn2++ SO42- AC 用MnO2将Fe2+氧化成Fe3+ 取少量滤液,滴加KSCN溶液,若不显红色,则过滤后的溶液中不含Fe3+
【解析】(1)实验室进行过滤操作时用到的玻璃仪器有玻璃棒、烧杯和漏斗,故答案为:漏斗;
(2)浸出后,锰主要以Mn2+的形式存在,则MnO2与SO2反应将二氧化硫氧化为硫酸根,反应的离子方程式为MnO2+SO2 =Mn2++ SO42-,故答案为:MnO2+SO2 =Mn2++ SO42-;
(3)浸出过程的副反应之一是部分SO2被氧化为硫酸,致使浸出液的pH下降,这将不利于软锰矿浆继续吸收SO2。A.MnCO3可以与硫酸反应生成二氧化碳和硫酸锰,正确;B.MnO2与硫酸不反应,错误;C.Mn(OH)2与硫酸发生中和反应生成硫酸锰,正确;D.MnSO4与硫酸不反应,错误;故选AC;
(4)根据流程图,操作I中二氧化锰将Fe2+氧化成Fe3+,然后调节溶液的pH至3~4,使铁离子沉淀除去;检验过滤后的滤液中是否含有Fe3+,可以取少量滤液,滴加KSCN溶液,若不显红色,则过滤后的溶液中不含Fe3+,故答案为:用MnO2将Fe2+氧化成Fe3+;取少量滤液,滴加KSCN溶液,若不显红色,则过滤后的溶液中不含Fe3+。

 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案