题目内容
(1)原电池反应通常是放热反应,下列化学反应在理论上可设计成原电池是______,理由是______.
A.C(s)+H2O(g)=CO(g)+H2(g)△H>O
B.C(s)+CO2(g)=2CO(g)△H>O
C.CaC2(s)+2H2O (g)=Ca(OH)2(l)+C2H2(g)△H<O
D.CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H<O
(2)以KOH溶液为电解质溶液,依据(1)所选反应设计一个原电池,其负极反应式为______;
以H2SO4溶液为电解质溶液,将(1)中D选项的CH4改为C6H12O6,其负极反应式为______.
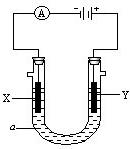
(3)电解原理在化工上有着广泛的应用,现将你设计的原电池通过导线与右图中的电解池相连,其中a为电解质溶液,X和Y为两块电极板,则:
①若X和Y均为惰性电极,a为饱和的NaCl溶液,则检验Y电极产物的方法是______;
②若X和Y分别为石墨和铁,a仍为饱和的NaCl溶液,则阳极反应式为______;
③若X和Y均为惰性电极,a为CuSO4溶液,电解一段时间后,向所得溶液中加入0.1mol的Cu(OH)2,恰好使溶液恢复电解前的浓度和PH,则电解过程中阳极产生的气体体积(标况下)为______.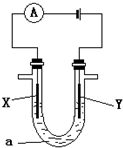
A.C(s)+H2O(g)=CO(g)+H2(g)△H>O
B.C(s)+CO2(g)=2CO(g)△H>O
C.CaC2(s)+2H2O (g)=Ca(OH)2(l)+C2H2(g)△H<O
D.CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H<O
(2)以KOH溶液为电解质溶液,依据(1)所选反应设计一个原电池,其负极反应式为______;
以H2SO4溶液为电解质溶液,将(1)中D选项的CH4改为C6H12O6,其负极反应式为______.
(3)电解原理在化工上有着广泛的应用,现将你设计的原电池通过导线与右图中的电解池相连,其中a为电解质溶液,X和Y为两块电极板,则:
①若X和Y均为惰性电极,a为饱和的NaCl溶液,则检验Y电极产物的方法是______;
②若X和Y分别为石墨和铁,a仍为饱和的NaCl溶液,则阳极反应式为______;
③若X和Y均为惰性电极,a为CuSO4溶液,电解一段时间后,向所得溶液中加入0.1mol的Cu(OH)2,恰好使溶液恢复电解前的浓度和PH,则电解过程中阳极产生的气体体积(标况下)为______.

(1)能构成原电池的条件之一是:该反应是放热反应,即△H<O,且该反应必须是能自发进行的氧化还原反应.
A、该反应是吸热反应,故错误.
B、该反应是吸热反应,故错误.
C、该反应不是氧化还原反应,故错误.
D、该反应是放热反应且是能自发进行的氧化还原反应,故正确.
故答案为:D;理由是:该反应既是放热反应,又是自发的氧化还原反应.
(2)碱性条件下,甲烷失电子和氢氧根离子反应生成碳酸根离子和水,电极反应式为CH4+10OH--8e=CO32-+7H2O;
酸性条件下,C6H12O6失电子和水反应生成二氧化碳和氢离子,电极反应式为 C6H12O6-24e+6H2O=6CO2+24H+.
故答案为:CH4+10OH--8e=CO32-+7H2O; C6H12O6-24e+6H2O=6CO2+24H+.
(3)①当石墨作电极时,阳极Y上氯离子失电子生成氯气,氯气有氧化性能和碘离子发生置换反应生成碘单质,淀粉遇碘变蓝色,所以检验氯气的方法是将湿润的淀粉KI试纸靠近Y极支管口处,试纸变蓝,说明有氯气生成.
故答案为:将湿润的淀粉KI试纸靠近Y极支管口处,试纸变蓝,说明有氯气生成.
②当较活泼的金属铁作阳极时,金属铁失电子生成二价铁离子,电极反应式为Fe-2e=Fe 2+.
故答案为Fe-2e=Fe 2+.
③根据“电解出什么物质加入什么物质”的方法知,加入Cu(OH)2相当于加入CuO.H2O,所以发生电解时分两段,一段是生成氧气和铜,一段是生成氢气和氧气.
当生成氧气和铜时,根据原子守恒知:0.1mol的Cu(OH)2相当于有0.1molCuO,所以生成0.05mol氧气;
0.1mol的Cu(OH)2相当于有0.1molH2O,电解0.1mol水生成0.05mol氧气.
所以阳极上产生的氧气的体积=(0.05+0.05)mol×22.4L/mol=2.24L.
故答案为:2.24L.
A、该反应是吸热反应,故错误.
B、该反应是吸热反应,故错误.
C、该反应不是氧化还原反应,故错误.
D、该反应是放热反应且是能自发进行的氧化还原反应,故正确.
故答案为:D;理由是:该反应既是放热反应,又是自发的氧化还原反应.
(2)碱性条件下,甲烷失电子和氢氧根离子反应生成碳酸根离子和水,电极反应式为CH4+10OH--8e=CO32-+7H2O;
酸性条件下,C6H12O6失电子和水反应生成二氧化碳和氢离子,电极反应式为 C6H12O6-24e+6H2O=6CO2+24H+.
故答案为:CH4+10OH--8e=CO32-+7H2O; C6H12O6-24e+6H2O=6CO2+24H+.
(3)①当石墨作电极时,阳极Y上氯离子失电子生成氯气,氯气有氧化性能和碘离子发生置换反应生成碘单质,淀粉遇碘变蓝色,所以检验氯气的方法是将湿润的淀粉KI试纸靠近Y极支管口处,试纸变蓝,说明有氯气生成.
故答案为:将湿润的淀粉KI试纸靠近Y极支管口处,试纸变蓝,说明有氯气生成.
②当较活泼的金属铁作阳极时,金属铁失电子生成二价铁离子,电极反应式为Fe-2e=Fe 2+.
故答案为Fe-2e=Fe 2+.
③根据“电解出什么物质加入什么物质”的方法知,加入Cu(OH)2相当于加入CuO.H2O,所以发生电解时分两段,一段是生成氧气和铜,一段是生成氢气和氧气.
当生成氧气和铜时,根据原子守恒知:0.1mol的Cu(OH)2相当于有0.1molCuO,所以生成0.05mol氧气;
0.1mol的Cu(OH)2相当于有0.1molH2O,电解0.1mol水生成0.05mol氧气.
所以阳极上产生的氧气的体积=(0.05+0.05)mol×22.4L/mol=2.24L.
故答案为:2.24L.

练习册系列答案
相关题目
 (1)原电池反应通常是放热反应,下列化学反应在理论上可设计成原电池是
(1)原电池反应通常是放热反应,下列化学反应在理论上可设计成原电池是