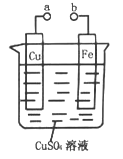
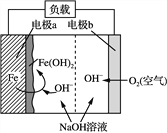
题目内容
【题目】下列过程没有发生化学反应的是
A. 用消毒液杀灭游泳池中的藻类 B. 用CaCl2融化路面的积雪
C. 用石灰修复被酸雨浸蚀的土壤 D. 用催化剂将汽车尾气中的CO和NO转化为无害物质
【答案】B
【解析】
试题A.消毒液杀灭游泳池中的藻类,是利用了消毒液的强氧化性,使藻类的细胞组织变性,发生了化学反应;B.用CaCl2融化路面的积雪,是降低了冰的凝固点,是物理变化;C.用石灰修复被酸雨浸蚀的土壤,是利用石灰的碱性,与酸性土壤发生了酸碱中和反应;D.用催化剂将汽车尾气中的CO和NO转化为无害物质,有新物质生成,是化学变化。故选B。

 考前必练系列答案
考前必练系列答案【题目】描述弱电解质电离情况可以用电离度和电离平衡常数表示,下表是常温下几种弱电解质的电离平衡常数:
酸或碱 | 电离常数(Ka或Kb) | 难(微)溶物 | 溶度积常数(Ksp) |
CH3COOH | 1.8×10-5 | BaSO4 | 1×10-10 |
HNO2 | 4.6×10-4 | BaCO3 | 2.6×10-9 |
HCN | 5×10-10 | CaSO4 | 7×10-5 |
HClO | 3×10-8 | CaCO3 | 5×10-9 |
NH3·H2O | 1.8×10-5 |
请回答下面问题:
(1)上述四种酸中,酸性最弱的是_____________ (用化学式表示)。下列能使醋酸溶液中CH3COOH的电离程度增大,而电离常数不变的操作是________________(填序号)。
A.升高温度 B.加水稀释
C.加少量的CH3COONa固体 D.加少量冰醋酸
(2)CH3COONH4的水溶液呈________ (选填“酸性”“中性”或“碱性”),理由是__________________,溶液中各离子浓度大小的关系是_____________________。
(3)物质的量1∶1的NaCN和HCN的混合溶液,其pH>7,该溶液中离子的浓度从大到小排列为_____________________________________。
(4)工业中常将BaSO4转化为BaCO3后,再将其制成各种可溶性的钡盐(如:BaCl2)。具体做法是用饱和的纯碱溶液浸泡BaSO4粉末,并不断补充纯碱,最后BaSO4转化为BaCO3。现有足量的BaSO4悬浊液,在该悬浊液中加纯碱粉末并不断搅拌,为使SO42-物质的量浓度达到0.0lmol·L-1以上,则溶液中CO32-物质的量浓度应 ≥____________mol·L-1。
【题目】表是元素周期表中短周期元素的一部分,表中所列字母分别代表一种元素。
A | B | ||||||
D | E | F | |||||
C | G | H |
(1)上述元素的单质中熔点最高的可能是________________(填名称)。
(2)D的氢化物比G的氢化物稳定,其原因是__________________________________________________________。
(3)在一定条件下,A与E可形成一种极易溶于水的气态化合物,其电子式为___________;该物质溶于水后的溶液呈________性(填“酸”、“碱”或“中”)。
(4)现有另一种元素X,其原子获得一个电子所释放出的能量是上表中所列元素中最大的,则X是周期表中第__________族元素。
(5)“神舟”六号载人飞船内需要有一种化合物来吸收航天员呼出的CO2,你认为该物质应该是由上表中的___________(填字母代号)元素组成的,用化学方程式表示吸收原理_________________________________________________________________。
飞船中需要制造一种适合航天员生存的人工态环境,还应该在氧气中充入一种稀释气体,该气体化学式为______________。