题目内容
【题目】X、Y、Z 为原子序数 1~20 号内的元素,将 4.7g X 的最高价氧化物X2O溶于 95.3g 水中,所 得溶液浓度为 5.6% 。Y 元素原子与 X 元素原子的最外电子层电子数相同,12g Y 的氢氧化物恰好被0.75 mol/L 的盐酸 400mL 所中和。Z、Y 的原子核外电子层数相同,16g ZO2气体在标准状况下的体积 为 5.6L。试求 X、Y、Z 元素名称。X______________,Y_______________,Z____________
【答案】K Na S
【解析】
主族元素X的最高价氧化物X2O,X处于IA族,溶于水生成XOH,4.7g X2O 溶于95.3g水中,得到溶质质量分数为5.6%的溶液,则XOH的质量=(4.7g+95.3g)×5.6%=5.6g,令X的相对原子质量为a,则根据X原子守恒:2×![]() =
=![]() ,解得a=39,元素Y与X同主族,则Y也处于IA族,其氢氧化物为YOH,与盐酸发生中和反应,设Y的相对原子质量b,则
,解得a=39,元素Y与X同主族,则Y也处于IA族,其氢氧化物为YOH,与盐酸发生中和反应,设Y的相对原子质量b,则![]() =0.75mol/L×0.4L,解得b=23,标况下ZO2的物质的量为
=0.75mol/L×0.4L,解得b=23,标况下ZO2的物质的量为![]() =0.25mol,ZO2的摩尔质量为
=0.25mol,ZO2的摩尔质量为![]() =64g/mol,则Z的相对分子质量为64-32=32,X、Y处于IA族,X相对原子质量为39,Y的相对原子质量为23,则X为K,Y为Na,Z的相对原子质量为32,且Z与Na同周期,故Z为S,故答案为:K;Na;S。
=64g/mol,则Z的相对分子质量为64-32=32,X、Y处于IA族,X相对原子质量为39,Y的相对原子质量为23,则X为K,Y为Na,Z的相对原子质量为32,且Z与Na同周期,故Z为S,故答案为:K;Na;S。

【题目】为模拟海水制备 MgO,某同学设计并完成了如下实验:
模拟海水中离子c(mol/L) | Na+ | Mg2+ | Ca2+ | Cl― | HCO3 |
0.439 | 0.050 | 0.011 | 0.560 | 0.001 |
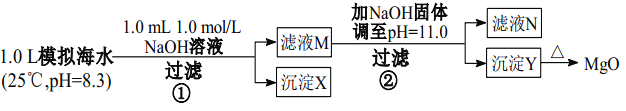
下列说法正确的是
A. 模拟海水呈碱性,可说明 HCO3-的电离能力大于水解能力
B. 沉淀物 X 为 CaCO3,沉淀物 Y 为 Mg(OH)2
C. MgCO3的溶解度比 Mg(OH)2 的小
D. 滤液 M 中存在 Mg2+,不存在 Ca2+



