题目内容
硫元素的化合物在生产、生活中有着广泛的应用。
(1)400℃,1.01×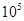 Pa下,容积为1.0L的密闭容器中充入0.5molSO2,(g)和0.3 molO2 (g),发生
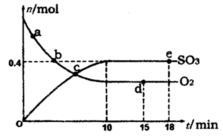
Pa下,容积为1.0L的密闭容器中充入0.5molSO2,(g)和0.3 molO2 (g),发生 反应中n(SO3)和n(O2)随时间变化的关系如图所示。反应的平衡常数K=_______;0到10 min内用SO2:表示的平均反应速率_________。更具图中信息,判断下列叙述中正确的是_____(填序号)。
反应中n(SO3)和n(O2)随时间变化的关系如图所示。反应的平衡常数K=_______;0到10 min内用SO2:表示的平均反应速率_________。更具图中信息,判断下列叙述中正确的是_____(填序号)。
(2)用NaOH溶液吸收工业废气中的SO2,当吸收液失去吸收能力时,25℃时测得溶液的pH=5.6,溶液中Na+,H+, HSO- 3,SO2- 3离子的浓度由大到小的顺序是__________________
(3)可通过电解法使(2)中的吸收液再生而循环利用(电极均为石墨电极),其工作示意图如下:
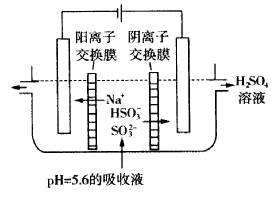
HSO- 3在阳极室反应的电极反应式为_______________________________.
阴极室的产物_________________。
(1)400℃,1.01×
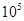 Pa下,容积为1.0L的密闭容器中充入0.5molSO2,(g)和0.3 molO2 (g),发生
Pa下,容积为1.0L的密闭容器中充入0.5molSO2,(g)和0.3 molO2 (g),发生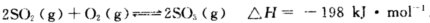 反应中n(SO3)和n(O2)随时间变化的关系如图所示。反应的平衡常数K=_______;0到10 min内用SO2:表示的平均反应速率_________。更具图中信息,判断下列叙述中正确的是_____(填序号)。
反应中n(SO3)和n(O2)随时间变化的关系如图所示。反应的平衡常数K=_______;0到10 min内用SO2:表示的平均反应速率_________。更具图中信息,判断下列叙述中正确的是_____(填序号)。
| A.a点时刻的正反应速率比b点时刻的大 |
| B.c点时刻反应达到平衡状态 |
| C.d点和e点时刻的c(O2)相同 |
D.若5 00℃,1.01×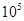 Pa下,反应达到平衡时,n( SO3)比图中e点时刻的值大 Pa下,反应达到平衡时,n( SO3)比图中e点时刻的值大 |
(3)可通过电解法使(2)中的吸收液再生而循环利用(电极均为石墨电极),其工作示意图如下:

HSO- 3在阳极室反应的电极反应式为_______________________________.
阴极室的产物_________________。
(12分)
(1)160 (mol·L-1)-1(2分); 0.04 mol·L-1·min-1(2分);AC(2分)
(2)c(Na+)>c(HSO3-)>c(H+)>c(SO32-)(2分)
(3)HSO- 3+H2O=SO2- 4+3H++2e- (2分) H2、NaOH(2分)
(1)160 (mol·L-1)-1(2分); 0.04 mol·L-1·min-1(2分);AC(2分)
(2)c(Na+)>c(HSO3-)>c(H+)>c(SO32-)(2分)
(3)HSO- 3+H2O=SO2- 4+3H++2e- (2分) H2、NaOH(2分)
试题分析:
(1)在10min时建立平衡:2SO2 + O2
 2SO3
2SO3始态0.5mol 0.3 mol 0mol
变化量0.4mol 0.2mol 0.4mol
终态0.1mol 0.1 mol 0.4mol
平衡常数K=
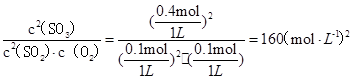 ;SO2的平均反应速率=0.4mol/(1L×10min)=" 0.04" mol·L-1·min-1;A.a点反应正向进行,反应物在减少,所以a点时刻的正反应速率比b点时刻的大,正确;B.在10min时建立平衡,各物质的量不在改变,错误;C.d点和e点是相同的平衡状态,所以d点和e点时刻的c(O2)相同,正确; D.放热反应,温度越高,平衡逆向移动n( SO3)碱小,错误
;SO2的平均反应速率=0.4mol/(1L×10min)=" 0.04" mol·L-1·min-1;A.a点反应正向进行,反应物在减少,所以a点时刻的正反应速率比b点时刻的大,正确;B.在10min时建立平衡,各物质的量不在改变,错误;C.d点和e点是相同的平衡状态,所以d点和e点时刻的c(O2)相同,正确; D.放热反应,温度越高,平衡逆向移动n( SO3)碱小,错误(2)用NaOH溶液吸收工业废气中的SO2,当吸收液失去吸收能力时,,溶质应为亚硫酸氢钠。HSO- 3的电离程度大于水解程度,所以c(Na+)> c(HSO- 3)> c(H+)> c(SO2-3)> c(OH-)。
(3)HSO- 3在阳极室反应的电极反应式HSO- 3+H2O=SO2- 4+3H++2e-;阳极室氢离子放电,产物为H2、NaOH。

练习册系列答案
相关题目
 N2O4(g)△H<0
N2O4(g)△H<0 2O3(g)△H>0
2O3(g)△H>0 2C(g) △H<0。2 min后,反应达到平衡,生成C为1.6 mol。则下列分析正确的是 ( )
2C(g) △H<0。2 min后,反应达到平衡,生成C为1.6 mol。则下列分析正确的是 ( ) 2C(g),有关下列图像说法的不正确的是
2C(g),有关下列图像说法的不正确的是
 2Z,其平衡常数值为1600
2Z,其平衡常数值为1600 NH3(g) + HI(g)
NH3(g) + HI(g)
 CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据: (4)寻找新能源是解决温室效应的一条重要思路。磷酸亚铁锂LiFePO4是一种新型汽车锂离子电池,总反应为:FePO4+Li LiFePO4,电池中的固体电解质可传导Li+,则该电池放电时的正极和负极反应式分别为: 和 。若用该电池电解蒸馏水(电解池电极均为惰性电极),当电解池两极共有3360mL气体(标准状况)产生时,该电池消耗锂的质量为 。(Li的相对原子质量约为7.0)
(4)寻找新能源是解决温室效应的一条重要思路。磷酸亚铁锂LiFePO4是一种新型汽车锂离子电池,总反应为:FePO4+Li LiFePO4,电池中的固体电解质可传导Li+,则该电池放电时的正极和负极反应式分别为: 和 。若用该电池电解蒸馏水(电解池电极均为惰性电极),当电解池两极共有3360mL气体(标准状况)产生时,该电池消耗锂的质量为 。(Li的相对原子质量约为7.0)