题目内容
【题目】25℃时,部分含Fe元素的徽粒在溶液中的物质的量分数与溶液pH的关系如图所示,下列说法正确的是

A. HFeO4-在水中的电离程度小于水解程度
B. B、C两点对应溶液中水的电离程度:B > C
C. B点溶液加适里水稀释,溶液中所有离子浓度均减小
D. 由A点数据可知,H2FeO4的第一步电离平衡常数Ka1=4.15×l0-4
【答案】D
【解析】A. HFeO4-在水中既能电离又能水解,其电离使溶液显酸性,其水解使溶液显碱性,由图像可知,物质的量分数最大时pH约为5,所以电离程度大于水解程度,A不正确;B. B点pH约为3,溶液显酸性,溶液的酸性是由高铁酸和高铁酸氢根的电离决定的,而C点的pH约为7,是由高铁酸氢根的电离和高铁酸根的水解共同决定的,酸的电离对水的电离有抑制作用,酸性越强,抑制作用越大,而酸根水解会促进水的电离 ,溶液的pH越大,则对水的电离的促进作用就越大,所以B、C两点对应溶液中水的电离程度:B < C,所以B不正确;C. B点溶液加适里水稀释,溶液中所有离子浓度均减小肯定是不正确的,因为在一定温度下,水的离子积是定值,所以不可能均减小,C不正确;D. 由A点数据可知,A点对应的溶液中pH=4,HFeO4-的物质的量分数为80.6%,则H2FeO4的物质的量分数为19.4%,所以两者的物质的量之比为![]() = 4.15,c(H+)=10-4mol/L,H2FeO4的第一步电离平衡常数Ka1=
= 4.15,c(H+)=10-4mol/L,H2FeO4的第一步电离平衡常数Ka1= 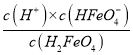 = 4.15×l0-4,D正确。
= 4.15×l0-4,D正确。

 提分百分百检测卷系列答案
提分百分百检测卷系列答案 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案 能考试全能100分系列答案
能考试全能100分系列答案【题目】下列操作和现象所得结论正确的是
选项 | 操作和现象 | 结论 |
A | 其他条件不变,缩小H2(g)+I2(g) | 增大压强,平衡逆向移动 |
B | 向某溶液中滴加稀盐酸,再加KSCN溶液,溶液变为血红色 | 原溶液中一定含有Fe3+ |
C | 用滴定管量取20.00mL稀硫酸,初读数时尖嘴处有气泡,末读数时气泡消失 | 所取稀硫酸体积小于20.00mL |
D | 25℃时,分别测定等物质的量浓度的Na2C2O4溶液和NaF溶液的pH,前者pH大 | 酸性:H2C2O4<HF |
A. A B. B C. C D. D