题目内容
一定温度下,硫酸铜受热分解生成CuO、SO2、SO3和O2。已知:SO2、SO 3都能被碱石灰和氢氧化钠溶液吸收。用下图装置加热硫酸铜粉末直至完全分解。若硫酸铜粉末质量为10.0 g,完全分解后,各装置的质量变化关系如下表所示。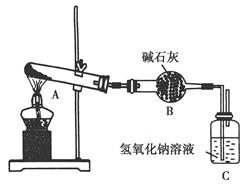
| 装置 | A(试管+粉末) | B | C |
| 反应前 | 42.0 g | 75.0 g | 140.0 g |
| 反应后 | 37.0 g | 79.5 g | 140.0 g |
请通过计算,推断出该实验条件下硫酸铜分解的化学方程式是( )
A.4CuSO4
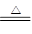 4CuO+2SO3↑+2SO2↑+O2↑
4CuO+2SO3↑+2SO2↑+O2↑B.3CuSO4
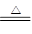 3CuO+SO3↑+2SO2↑+O2↑
3CuO+SO3↑+2SO2↑+O2↑C.5CuSO4
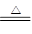 5CuO+SO3↑+4SO2↑+2O2↑
5CuO+SO3↑+4SO2↑+2O2↑D.6CuSO4
 6CuO+4SO3↑+2SO2↑+O2↑
6CuO+4SO3↑+2SO2↑+O2↑
A
解析

练习册系列答案
相关题目
下图装置可用于收集气体并验证其化学性质,下列对应关系完全正确的是
| 选项 | 气体 | 试剂 | 现象 | 结论 |
| A | NO | 紫色石蕊试液 | 溶液变红 | NO与水反应生成硝酸 |
| B | Cl2 | KI淀粉溶液 | 溶液变蓝 | Cl2有氧化性 |
| C | SO2 | 酸性KMnO4溶液 | 溶液褪色 | SO2有漂白性 |
| D | NH3 | 酚酞试剂 | 溶液变红 | NH3有碱性 |
汉代器物上的颜料“汉紫”至今尚没有发现其自然存在的记载。20世纪80年代科学家进行超导材料研究时,偶然发现其成分为紫色的硅酸铜钡(化学式:BaCuSi2Ox,Cu为+2价),下列有关“汉紫”的说法中不正确的是( )。
| A.用盐的形式表示:BaSiO3·CuSiO3 |
| B.用氧化物形式表示:BaO·CuO·2SiO2 |
| C.易溶于强酸、强碱 |
| D.性质稳定,不易褪色 |
某种混合气体可能含有N2、HCl、CO、CO2,把混合气体依次通过足量的饱和NaHCO3溶液和灼热的氧化铜粉末,气体体积均没有明显变化;再通过足量的过氧化钠固体,气体体积减小;最后经过铜网,经充分反应后气体体积又减小了,但还有剩余气体。以下对该混合气体组成的判断正确的是( )
| A.一定没有N2和CO2,CO和HCl中至少有一种 |
| B.一定有N2、CO和HCl,一定没有CO2 |
| C.一定有N2,CO2、CO、HCl三者中至少有一种 |
| D.一定有N2和CO2,没有CO和HCl |
甲、乙、丙三溶液各含有一种X-(X-为Cl-、Br-或I-),向甲中加入淀粉溶液和氯水,则溶液变为橙色,再加丙溶液,颜色无明显变化。则甲、乙、丙依次含有( )。
| A.Br-、I-、Cl- | B.Br-、Cl-、I- |
| C.I-、Br-、Cl- | D.Cl-、I-、Br- |
如图所示是一系列含硫化合物的转化关系(反应中生成的水已略去),其中说法正确的是( )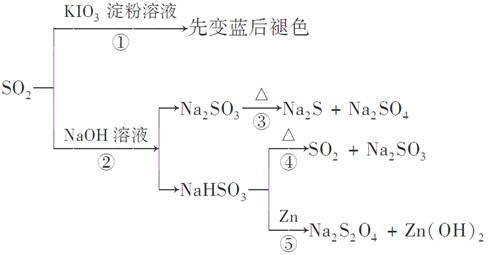
| A.反应①说明SO2具有漂白性,反应②说明SO2具有酸性 |
| B.反应②中生成物n(Na2SO3):n(NaHSO3)=1:1时,则反应物n(SO2):n(NaOH)=1:2 |
| C.反应③④⑤均属于氧化还原反应 |
| D.工业上可利用反应②和反应④回收SO2 |
在氯水中存在多种分子和离子,可通过实验的方法加以确定,下列说法中可能错误的是( )
| A.加入含有NaOH的酚酞试液,红色褪去,说明有H+存在 |
| B.加入有色布条后,有色布条褪色,说明有HClO分子存在 |
| C.氯水呈浅黄色,且有刺激性气味,说明有Cl2分子存在 |
| D.加入硝酸酸化的AgNO3溶液产生白色沉淀,说明有Cl-存在 |