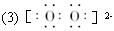题目内容
据著名网站网易报道,意大利科学家使用普通氧分子和带正电的氧化离子作用,制出了新型的氧分子O4,它的结构很复杂,可能具有与S4相似的长方形结构。(1)下列有关O4的说法正确的是…( )
A.O4分子内存在极性共价键
B.合成O4的反应可看作核聚变反应,即不属于化学变化
C.O4与O3、O2都是氧的同素异形体
D.O4将来可用作更强有力的火箭推进的氧化剂
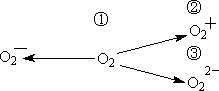
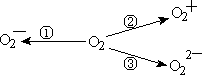
(2)含![]() 、
、![]() 甚至
甚至![]() 的化合物都是可能存在的,通常它们是在氧分子进行下列各种反应时生成的:
的化合物都是可能存在的,通常它们是在氧分子进行下列各种反应时生成的:
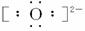
上述反应中,__________(填序号)相当于氧分子的氧化;__________(填序号)相当于氧分子的还原。
(3)写出![]() 的电子式:__________。
的电子式:__________。
(4)化合物O2[PtF6]中含有![]() ,则O2[PtF6]属于__________ (填“离子”或“共价”)化合物,有一种常见的含有
,则O2[PtF6]属于__________ (填“离子”或“共价”)化合物,有一种常见的含有![]() 的氧化物可用作宇宙飞船中氧气来源,写出该反应的化学方程式:__________。
的氧化物可用作宇宙飞船中氧气来源,写出该反应的化学方程式:__________。
解析:(1)由于构成O4分子的原子是同一种原子(氧原子),原子与原子之间的共用电子对不偏移,因此原子间形成的都是非极性键,故A错误。核聚变反应是在反应中原子核发生变化生成新的原子核,即生成了新的原子,核反应不属于化学变化,而合成O4的反应并没有新核生成,所以不是核聚变反应,而为化学变化,故B错误。O4为同一种原子构成的分子,因此它是一种单质,与臭氧互为同素异形体,故C正确。O4把更多氧原子集中在同样大小的空间里,因此它液化后的能量、密度均将高于普通液态氧,可用作更强有力的火箭推进氧化剂,故D正确。(2)根据氧元素化合价的变化或得失电子进行判断,元素的化合价升高的(失电子)为氧化反应,反之为还原反应。(3)考查阴离子电子式的书写,书写时应根据氧原子最外层电子数及化学键的形成进行分析,一般要达到8电子稳定结构。(4)考查对离子化合物的判断,由阴、阳离子形成的化合物为离子化合物。常见的含有![]() 的氧化物为比Na活泼的K所对应的KO2;化学方程式的书写依照CO2与Na2O2反应即可写出,根据得失电子数目守恒配平氧化还原反应方程式。
的氧化物为比Na活泼的K所对应的KO2;化学方程式的书写依照CO2与Na2O2反应即可写出,根据得失电子数目守恒配平氧化还原反应方程式。
答案:(1)CD (2)② ①③ (3)![]()
(4)离子 4KO2+2CO2====2K2CO3+3O2

| |||||||||||||||||||
| |||||||||||||||||||