题目内容
【题目】氢气是一种十分熟悉的物质.在许多反应中既可以作为反应物,也可以作物生成物.
(1)电解饱和食盐水制取氢气,反应的化学方程式
(2)在氢气还原氧化铜的反应中,标出电子转移的方向及数目. H2+CuO ![]() Cu+H2O.
Cu+H2O.
(3)在铜锌原电池中,如图,在铜极附近看到的现象是;电子流向从 .
(4)氢气作为燃料,有1g氢气燃烧生成液态水放出142.8kJ热量,表示该反应的热化学方程式;
(5)实验室用锌与稀硫酸反应制取氢气.某学校实验员为了提高制取氢的速度,在此溶液中加入少量硫酸铜溶液,你认为合理吗?为什么? . 
【答案】
(1)2NaCl+2H2O ![]() 2NaOH+H2↑+Cl2↑
2NaOH+H2↑+Cl2↑
(2)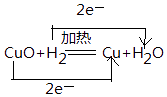
(3)Cu电极上产生气泡;电子从Zn电极沿导线流向Cu电极
(4)H2(g)+ ![]() O2(g)=H2O(l)△H=﹣285.8kJ/mol
O2(g)=H2O(l)△H=﹣285.8kJ/mol
(5)因为Zn置换出硫酸铜溶液中的Cu,Zn、Cu和稀硫酸构成原电池,原电池能加快化学反应速率,所以该操作能提高制取氢气的速率
【解析】解:(1)用惰性电极电解饱和食盐水时,阳极上氯离子失电子生成氯气,阴极上水得电子生成氢气同时生成氢氧根离子,则电池反应式为2NaCl+2H2O ![]() 2NaOH+H2↑+Cl2↑,
2NaOH+H2↑+Cl2↑,
所以答案是:2NaCl+2H2O ![]() 2NaOH+H2↑+Cl2↑;(2)该反应中H元素化合价由0价变为+1价、Cu元素化合价由+2价变为0价,转移电子数为2,电子转移方向和数目为
2NaOH+H2↑+Cl2↑;(2)该反应中H元素化合价由0价变为+1价、Cu元素化合价由+2价变为0价,转移电子数为2,电子转移方向和数目为 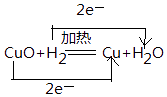 ,
,
所以答案是: 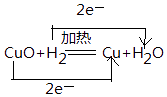 ;(3)该铜锌原电池中,Zn易失电子生成锌离子而作负极,Cu作正极,Cu电极上氢离子得电子生成氢气,则Cu电极上看到的现象是:有气泡产生,在外电路中电子从负极沿导线流向正极,所以电子从Zn电极沿导线流向Cu电极,
;(3)该铜锌原电池中,Zn易失电子生成锌离子而作负极,Cu作正极,Cu电极上氢离子得电子生成氢气,则Cu电极上看到的现象是:有气泡产生,在外电路中电子从负极沿导线流向正极,所以电子从Zn电极沿导线流向Cu电极,
所以答案是:Cu电极上产生气泡;电子从Zn电极沿导线流向Cu电极;(4)n(H2)= ![]() =0.5mol,0.5mol氢气完全燃烧生成液态水放出142.8kJ热量,则1mol氢气完全燃烧生成液态水放出285.6kJ热量,其热化学方程式为H2(g)+
=0.5mol,0.5mol氢气完全燃烧生成液态水放出142.8kJ热量,则1mol氢气完全燃烧生成液态水放出285.6kJ热量,其热化学方程式为H2(g)+ ![]() O2(g)=H2O(l)△H=﹣285.8kJ/mol,
O2(g)=H2O(l)△H=﹣285.8kJ/mol,
所以答案是:H2(g)+ ![]() O2(g)=H2O(l)△H=﹣285.8kJ/mol;(5)Zn置换出硫酸铜溶液中的Cu,Zn、Cu和稀硫酸构成原电池,原电池能加快化学反应速率,所以在此溶液中加入少量硫酸铜溶液能提高制取氢气的速度,
O2(g)=H2O(l)△H=﹣285.8kJ/mol;(5)Zn置换出硫酸铜溶液中的Cu,Zn、Cu和稀硫酸构成原电池,原电池能加快化学反应速率,所以在此溶液中加入少量硫酸铜溶液能提高制取氢气的速度,
所以答案是:合理;因为Zn置换出硫酸铜溶液中的Cu,Zn、Cu和稀硫酸构成原电池,原电池能加快化学反应速率,所以该操作能提高制取氢气的速率.

 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案