题目内容
某化学兴趣小组的同学为模拟工业制造硫酸的生产过程,设计了如图所示的装置,请根据要求回答问题:
(1)装置A用来制取氧气,写出相应的化学方程式__________________________;
(2)燃烧炉内放一定量黄铁矿粉末,在高温条件下和A装置制出的氧气充分反应,其化学方程式为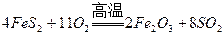 ,在该反应中____________做氧化剂;若消耗了
,在该反应中____________做氧化剂;若消耗了 有_______________mol电子发生了转移;
有_______________mol电子发生了转移;
(3)C装置为净化装置,若无该装置,将混合气体直接通入D装置,除对设备有腐蚀外,还会造成的后果是_______________________________________________;
(4)如果D装置的温度是400℃~500℃,在常压下生成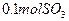 ,可放出
,可放出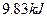 的热量,请写出该反应的热化学方程式________________________________________;并回答在工业中不采取加压措施的原因_ ____________________________。
的热量,请写出该反应的热化学方程式________________________________________;并回答在工业中不采取加压措施的原因_ ____________________________。
(1)装置A用来制取氧气,写出相应的化学方程式__________________________;
(2)燃烧炉内放一定量黄铁矿粉末,在高温条件下和A装置制出的氧气充分反应,其化学方程式为
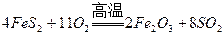 ,在该反应中____________做氧化剂;若消耗了
,在该反应中____________做氧化剂;若消耗了 有_______________mol电子发生了转移;
有_______________mol电子发生了转移;(3)C装置为净化装置,若无该装置,将混合气体直接通入D装置,除对设备有腐蚀外,还会造成的后果是_______________________________________________;
(4)如果D装置的温度是400℃~500℃,在常压下生成
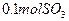 ,可放出
,可放出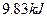 的热量,请写出该反应的热化学方程式________________________________________;并回答在工业中不采取加压措施的原因_ ____________________________。
的热量,请写出该反应的热化学方程式________________________________________;并回答在工业中不采取加压措施的原因_ ____________________________。(1)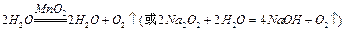 (2分)
(2分)
(2)氧气;1.1mol(4分) (3)催化剂中毒(1分)
(4)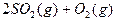
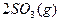 ;
;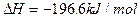 ;(2分)
;(2分)
在常压下400℃~500℃时,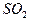 的转化率已相当高,加压对SO2的转化率提高不多,且加压对设备的要求高,增大投资和能量消耗。 (3分)
的转化率已相当高,加压对SO2的转化率提高不多,且加压对设备的要求高,增大投资和能量消耗。 (3分)
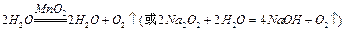 (2分)
(2分)(2)氧气;1.1mol(4分) (3)催化剂中毒(1分)
(4)
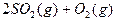
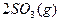 ;
;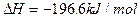 ;(2分)
;(2分)在常压下400℃~500℃时,
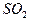 的转化率已相当高,加压对SO2的转化率提高不多,且加压对设备的要求高,增大投资和能量消耗。 (3分)
的转化率已相当高,加压对SO2的转化率提高不多,且加压对设备的要求高,增大投资和能量消耗。 (3分)(1)由装置A为固+液(不加热)型制取气体的装置,结合(2)中给出的提示:黄铁矿粉末在高温条件下和A装置制出的氧气充分反应,可联想到双氧水在二氧化锰作用下制氧气。(2)FeS2是还原剂,O2是氧化剂;
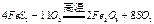 ~ 44 e-
~ 44 e-
4 44
0.1mol 1.1mol
所以有1.1mol电子发生了转移。 (4)中发生的反应为:2SO2+O2 2SO3 ~△H
(4)中发生的反应为:2SO2+O2 2SO3 ~△H
2 △H
0.1mol -9.83kJ
所以:△H=-196.6kJ/mol , 该反应的热化学方程式为:
该反应的热化学方程式为: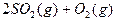
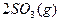 ;△H=-196.6kJ/mol 。
;△H=-196.6kJ/mol 。
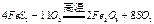 ~ 44 e-
~ 44 e-4 44
0.1mol 1.1mol
|
 (4)中发生的反应为:2SO2+O2 2SO3 ~△H
(4)中发生的反应为:2SO2+O2 2SO3 ~△H2 △H
0.1mol -9.83kJ
|
 该反应的热化学方程式为:
该反应的热化学方程式为: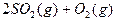
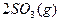 ;△H=-196.6kJ/mol 。
;△H=-196.6kJ/mol 。
练习册系列答案
相关题目
