题目内容
下列物质的用途,应用了氧化还原反应的是
| A.用食醋除去热水瓶胆壁上的水垢 | B.用次氯酸钠溶液消毒浴池 |
| C.盐卤用于制豆腐 | D.用小苏打发酵面团制作馒头 |
B
试题分析:食醋的主要成分是醋酸或乙酸,水垢的主要成分是碳酸钙,CH3COOH的酸性比碳酸强,则食醋能溶解热水瓶胆壁的水垢,生成乙酸钙、二氧化碳和水,该反应是复分解反应,无元素化合价变化,不涉及氧化还原反应,故A错误;次氯酸钠由次氯酸根离子和钠离子构成,次氯酸根离子具有强氧化性,其杀菌消毒是发生氧化还原反应,故B正确;豆浆的主要成分是胶体,盐卤的主要成分是电解质,这种胶体遇电解质溶液时发生凝聚,析出固体状的豆腐,这种过程无元素化合价变化,不涉及氧化还原反应,故C错误;小苏打的化学式NaHCO3,属于强碱弱酸盐,能水解,其溶液呈碱性,馒头的主要成分是淀粉,淀粉发酵时产生羧酸,羧酸的酸性比碳酸强,二者发生复分解反应,生成盐、二氧化碳气体和水,其中二氧化碳气体能使馒头体积增大,但是该过程中没有元素化合价变化,故D错误。

练习册系列答案
相关题目
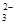 +O2+xOH—
+O2+xOH— +2H2O,
+2H2O,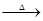 3HNCO;8HNCO+6NO2
3HNCO;8HNCO+6NO2