题目内容
现有AlCl3和FeCl3混合溶液,其中Al3+和Fe3+的物质的量之和为0.1mol,在此溶液中加入80mL 浓度为4mol/L的NaOH溶液,使其充分反应,设Al3+的物质的量与总物质的量的比值为x.(1)根据反应的化学方程式计算,当x=0.5 时,溶液中产生的沉淀及其物质的量是______.
(2)当沉淀中只有Fe(OH)3时,x的取值范围是______,请在图中画出沉淀总量(mol)随x(0→1.0)变化的曲线.
(3)若Al3+和Fe3+的物质的量之和为 n mol ( n为合理取值),其他条件不变,当沉淀中同时有Fe(OH)3、Al(OH)3时,x的取值范围是(用含有n、x的式子表示)______.
【答案】分析:(1)发生反应Fe3++3OH-=Fe(OH)3↓①Al3++3OH-=Al(OH)3↓②Al(OH)3+OH-=AlO2-+2H2O ③,OH-适量时,Al3+、Fe3+生成沉淀,当OH-过量时,Al(OH)3溶解,生成AlO2-. n(OH-)=0.08L×4mol/L=0.32mol,OH-对于两种离子生成沉淀是过量的,肯定可以使Al(OH)3溶解一些或全部,计算剩余的氢氧根离子物质的量,再根据Al(OH)3+OH-=AlO2-+2H2O进行计算,确定剩余氢氧化铝的物质的量,据此解答;
(2)计算Fe3+消耗的氢氧根离子的物质的量,进而计算Fe3+反应剩余的氢氧根离子的物质的量,沉淀中无Al(OH)3,剩余氢氧根离子的物质的量应≥0.4x,据此计算;
沉淀只有Fe(OH)3,计算沉淀Fe(OH)3的物质的量,沉淀中含有氢氧化铝时,沉淀总量=氢氧化铁的物质的量+与铝离子等物质的量的氢氧化铝的物质的量-0.02mol氢氧化钠溶解的氢氧化铝的物质的量,据此数据画出沉淀总量随x的变化曲线;
(3)计算Fe3+消耗的氢氧根离子的物质的量,进而计算Fe3+反应剩余的氢氧根离子的物质的量,沉淀中含有Al(OH)3,剩余氢氧根离子的物质的量应小于4倍铝离子的物质的量,据此计算.
解答:解:(1)发生反应Fe3++3OH-=Fe(OH)3↓①,Al3++3OH-=Al(OH)3↓②,
Al(OH)3+OH-=AlO2-+2H2O ③,
OH-适量时,Al3+、Fe3+生成沉淀,当OH-过量时,Al(OH)3溶解,生成AlO2-. Al3+和Fe3+的物质的量之和为0.1mol,完全沉淀需要消耗OH-物质的量为0.1mol×3=0.3mol,加入n(OH-)=0.08L×4mol/L=0.32mol,大于0.3mol,OH-对于两种离子生成沉淀是过量的,溶液中n(Al3+)=n(Fe3+)=0.1mol×0.5=0.05mol,
先发生①②,生成n[Al(OH)3]=n[Fe(OH)3]=0.05mol,
剩余OH-的物质的量为0.32mol-0.1mol×3=0.02mol,再发生反应③,溶解Al(OH)3为0.02mol,故沉淀中Al(OH)3
0.05mol-0.02mol=0.03mol,n[Fe(OH)3]=0.05mol,
故答案为:0.05 mol Fe(OH)3、0.03 mol Al(OH)3;
(2)Fe3+的物质的量为0.1mol×(1-x),消耗的OH-物质的量为0.1mol×(1-x)×3,Fe3+反应后剩余的OH-物质的量为0.32mol-0.1mol×(1-x)×3,沉淀中无Al(OH)3,则0.32mol-0.1mol×(1-x)×3≥0.1mol×x×4,解得x≤0.2,故0≤x≤0.2;
在0≤x≤0.2时,沉淀只有Fe(OH)3,Fe(OH)3沉淀量为0.1mol×(1-x)=0.1mol-0.1xmol,
0.2≤x≤1时,沉淀总量为:0.1mol×(1-x)+0.1mol×x-(0.32mol-0.1mol×3)=0.08mol,
故沉淀总量(mol)随x(0→1.0)变化的曲线为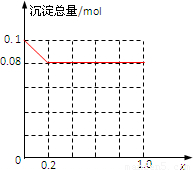 ;
;
故答案为:0≤x≤0.2;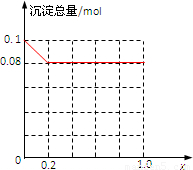 ;
;
(3)Fe3+的物质的量为nmol×(1-x),消耗的OH-物质的量为nmol×(1-x)×3,Fe3+反应后剩余的OH-物质的量为0.32mol-nmol×(1-x)×3,沉淀中有Al(OH)3,则0.32mol-nmol×(1-x)×3<nmol×x×4,解得x>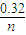 -3,故
-3,故
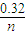 -3<x<1,
-3<x<1,
故答案为: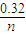 -3<x<1.
-3<x<1.
点评:本题考查混合物的有关计算,难度较大,清楚反应的过程是解题的关键,注意判断铝离子是否沉淀的特殊点.
(2)计算Fe3+消耗的氢氧根离子的物质的量,进而计算Fe3+反应剩余的氢氧根离子的物质的量,沉淀中无Al(OH)3,剩余氢氧根离子的物质的量应≥0.4x,据此计算;
沉淀只有Fe(OH)3,计算沉淀Fe(OH)3的物质的量,沉淀中含有氢氧化铝时,沉淀总量=氢氧化铁的物质的量+与铝离子等物质的量的氢氧化铝的物质的量-0.02mol氢氧化钠溶解的氢氧化铝的物质的量,据此数据画出沉淀总量随x的变化曲线;
(3)计算Fe3+消耗的氢氧根离子的物质的量,进而计算Fe3+反应剩余的氢氧根离子的物质的量,沉淀中含有Al(OH)3,剩余氢氧根离子的物质的量应小于4倍铝离子的物质的量,据此计算.
解答:解:(1)发生反应Fe3++3OH-=Fe(OH)3↓①,Al3++3OH-=Al(OH)3↓②,
Al(OH)3+OH-=AlO2-+2H2O ③,
OH-适量时,Al3+、Fe3+生成沉淀,当OH-过量时,Al(OH)3溶解,生成AlO2-. Al3+和Fe3+的物质的量之和为0.1mol,完全沉淀需要消耗OH-物质的量为0.1mol×3=0.3mol,加入n(OH-)=0.08L×4mol/L=0.32mol,大于0.3mol,OH-对于两种离子生成沉淀是过量的,溶液中n(Al3+)=n(Fe3+)=0.1mol×0.5=0.05mol,
先发生①②,生成n[Al(OH)3]=n[Fe(OH)3]=0.05mol,
剩余OH-的物质的量为0.32mol-0.1mol×3=0.02mol,再发生反应③,溶解Al(OH)3为0.02mol,故沉淀中Al(OH)3
0.05mol-0.02mol=0.03mol,n[Fe(OH)3]=0.05mol,
故答案为:0.05 mol Fe(OH)3、0.03 mol Al(OH)3;
(2)Fe3+的物质的量为0.1mol×(1-x),消耗的OH-物质的量为0.1mol×(1-x)×3,Fe3+反应后剩余的OH-物质的量为0.32mol-0.1mol×(1-x)×3,沉淀中无Al(OH)3,则0.32mol-0.1mol×(1-x)×3≥0.1mol×x×4,解得x≤0.2,故0≤x≤0.2;
在0≤x≤0.2时,沉淀只有Fe(OH)3,Fe(OH)3沉淀量为0.1mol×(1-x)=0.1mol-0.1xmol,
0.2≤x≤1时,沉淀总量为:0.1mol×(1-x)+0.1mol×x-(0.32mol-0.1mol×3)=0.08mol,
故沉淀总量(mol)随x(0→1.0)变化的曲线为
 ;
;故答案为:0≤x≤0.2;
 ;
;(3)Fe3+的物质的量为nmol×(1-x),消耗的OH-物质的量为nmol×(1-x)×3,Fe3+反应后剩余的OH-物质的量为0.32mol-nmol×(1-x)×3,沉淀中有Al(OH)3,则0.32mol-nmol×(1-x)×3<nmol×x×4,解得x>
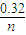 -3,故
-3,故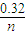 -3<x<1,
-3<x<1,故答案为:
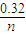 -3<x<1.
-3<x<1.点评:本题考查混合物的有关计算,难度较大,清楚反应的过程是解题的关键,注意判断铝离子是否沉淀的特殊点.

练习册系列答案
相关题目
 现有AlCl3和FeCl3混合溶液,其中Al3+和Fe3+的物质的量之和为0.1mol,在此溶液中加入80mL 浓度为4mol/L的NaOH溶液,使其充分反应,设Al3+的物质的量与总物质的量的比值为x.
现有AlCl3和FeCl3混合溶液,其中Al3+和Fe3+的物质的量之和为0.1mol,在此溶液中加入80mL 浓度为4mol/L的NaOH溶液,使其充分反应,设Al3+的物质的量与总物质的量的比值为x.