��Ŀ����
����Ŀ�����÷���м(��Ҫ�ɷ�ΪFe��������C��S��P��)��ȡ��Ч��ˮ��K2FeO4������ͼ��

����˵������ȷ����
A. ����м������ǰ�����ȵĴ�����Һȥ����
B. ������ǽ�Fe2+ת��ΪFe(OH)3
C. ������з����ķ�Ӧ�����ӷ���ʽΪ2Fe(OH)3+3ClO-==2FeO42-+3Cl-+4H++H2O
D. ������з�Ӧ�ܷ�����ԭ��������ͬ�����£�K2FeO4���ܽ��С��Na2FeO4
���𰸡�C
��������
����м(��Ҫ�ɷ�ΪFe��������C��S��P��)�������ܵõ������Σ����˺�����Һ�м������NaOH��Һ��H2O2��Һ��NaOH�к������ᣬFe2+��H2O2����ΪFe3+���ڼ���Һ�н���Һ��Fe2+ת��ΪFe(OH)3��Ȼ�����NaClO��Һ���ڼ���Һ�з���������ԭ��Ӧ����Na2FeO4������KCl���������ܽ�Ȳ�ͬת��ΪK2FeO4������
A. ������ǿ�������Σ�CO32ˮ��´�����Һ�ʼ��ԣ���������������ˮ�����ɸ�֬�����κ��ͣ����Է���м������ǰ�����ȵĴ�����Һȥ���ۣ���A��ȷ��
B.NaOH�к������ᣬFe2+��H2O2����ΪFe3+���ڼ���Һ�н���Һ��Fe2+ת��ΪFe(OH)3������ڵ�Ŀ���ǽ���Һ��Fe2+ת��ΪFe(OH)3����B��ȷ��
C. ������з����ķ�Ӧ�Ǽ��������·����ķ�Ӧ����Ӧ�����ӷ���ʽΪ2Fe(OH)3+4OH+3ClO�T2FeO42+3Cl+5H2O����C����
D. ������з�Ӧ�Ļ�ѧ����ʽΪ2KOH+Na2FeO4=K2FeO4+2NaOH���ܽ�ȴ����ת��Ϊ�ܽ��С�����ʣ���Ӧ�ܷ�����ԭ��K2FeO4���ܽ�ȱ�Na2FeO4С����D��ȷ��
��ѡC��

 �߲������Ӧ��һ��ͨϵ�д�
�߲������Ӧ��һ��ͨϵ�д�����Ŀ���Ȼ���ͭ��CuCl���������л��ϳɹ�ҵ�еĴ������ڿ�����Ѹ�ٱ����������ɫ������ֽ��ɺ�ɫ����ͼ�ǹ�ҵ��������ӡˢ��·�ķ�Һ����Fe3+��Cu2+��Fe2+��Cl������CuCl�����̣�
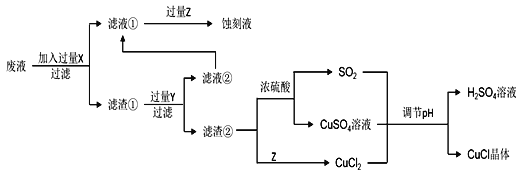
����������Ϣ�ش��������⣺
��1������������X�Ļ�ѧʽΪ____��
��2��д������CuCl�����ӷ���ʽ��____��
��3��ʵ��̽��pH��CuCl���ʵ�Ӱ�������ʾ��
pH | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
CuCl����/% | 70 | 90 | 82 | 78 | 75 | 72 | 70 |
����CuCl�������pHΪ____����pH�ϴ�ʱCuCl���ʱ��ԭ����____������pHʱ��___��������������������������ͬpH������������ᣬ������____��
��4���Ȼ���ͭ�Ķ���
�ٳ�ȡ��Ʒ0.25g������FeCl3��Һ����ƿ�У�����ܽ⡣
����0.10mol��L1���������Һ�ζ�����֪��CuCl+FeCl3=CuCl2+FeCl2��Fe2++Ce4+=Fe3++Ce3+������ƽ��ʵ���������ƽ��ʵ�������ܳ���1%����
ƽ��ʵ����� | 1 | 2 | 3 |
0.25g��Ʒ�������������Һ�������mL�� | 24.35 | 24.05 | 23.95 |
����Ʒ��CuCl�Ĵ���Ϊ_____�������������λ��Ч���֣���
��5����CuClˮ�����ȷֽ�ɵõ�����Cu2O����һ��CuClˮ������ӷ���ʽΪ��CuCl(s)��H2O(l)![]() CuOH(s)��Cl (aq)��H+(aq)���ڶ���CuOH�ȷֽ�Ļ�ѧ����ʽΪ____����һ��CuClˮ�ⷴӦ��ƽ�ⳣ��K����¶���KW��Ksp(CuOH)��Ksp(CuCl)�Ĺ�ϵΪK��____��
CuOH(s)��Cl (aq)��H+(aq)���ڶ���CuOH�ȷֽ�Ļ�ѧ����ʽΪ____����һ��CuClˮ�ⷴӦ��ƽ�ⳣ��K����¶���KW��Ksp(CuOH)��Ksp(CuCl)�Ĺ�ϵΪK��____��
����Ŀ����Դ������CO������Ҫ���塣
(1)CO����Ƴ�ȼ�ϵ�أ�����Li2CO3��Na2CO3�Ļ������Ϊȼ�ϵ�صĵ���ʣ��������Ǻ�CO2��O2������ʱ������ӦΪ__________________���Ը�ȼ�ϵ��Ϊ��Դ��������������������ɻ������ᣬͬʱ�Ƶø�����������װ����ͼ��ʾ(�缫��Ϊʯī�缫)����װ����Ӧѡ��_______(����������������)���ӽ���Ĥ��д�����ʱNO2������Ӧ�ĵ缫��Ӧʽ��___________________��

(2)CO�Ǹ�¯��������Ҫ��ԭ��������ʱ��������Ҫ��Ӧ�У�
��Ӧ | ��H(kJ/mol) |
I. Fe2O3(s)+3C(s) | +489 |
II. Fe2O3(s)+3CO(g) | -27 |
III. C(s)+CO2(g) | X |
�Լ��㣬�Լ��㣬X=_________��
T1��ʱ����ij�����ܱ������м���һ������Fe2O3��C��������ӦI����Ӧ�ﵽƽ�����t1ʱ�̸ı�ij������v(��)��ʱ��(t)�ı仯��ϵ��ͼ��ʾ����t1ʱ�̸ı������������_____________________��
a�������¶ȡ�������䣬ʹ�ô��� b������������䣬�����¶�
c�������¶Ȳ��䣬ѹ��������� d�������¶ȡ�������䣬����CO

(3)��һ���¶��£���ij����ɱ�ĺ�ѹ(P��)�ܱ������м���1mol CO2��������̼������ӦIII��ƽ��ʱ��ϵ����������������¶ȵĹ�ϵ��ͼ��ʾ��
��650��ʱ����Ӧ��ƽ���CO2��ת����Ϊ____________��
��T��ʱ���÷�Ӧ�ﵽƽ��ʱ����˵������ȷ����__________________��
a�������ܶȱ��ֲ���
b��2v��(CO2)=v��(CO)
c���������������������ٳ���������CO2��CO��ƽ�����淴Ӧ�����ƶ�
d���������������������ٳ���������壬v����v������С��ƽ�ⲻ�ƶ�
e���������������佫�������ѹ����һ�벢ά��������䣬�ٴδ�ƽ��ʱѹǿС��ԭƽ���2��
�۸���ͼ�����ݣ����㷴ӦIII��T��ʱ��ƽ���ѹ����ƽ��Ũ�ȱ�ʾ�Ļ�ѧƽ�ⳣ��KP=___________(����ѹǿΪP�����ú�P���Ĵ���ʽ��ʾ)
����Ŀ��ij�жԴ������м�⣬���ָ�����Ҫ��Ⱦ��Ϊ�����������PM2.5��ֱ��С�ڵ���2.5��m���������������Ҫ��ԴΪȼú��������β���ȡ���ˣ���PM2.5��SO2��NOx�Ƚ����о�������Ҫ���塣��ش��������⣺
��1����PM2.5����������ˮ�����Ƴɴ�������������ø���������ˮ���������ӵĻ�ѧ��ּ���ƽ��Ũ�����±���
���� | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
Ũ��/mol.L | 4��10-6 | 6��10-6 | 2��10-5 | 4��10-5 | 3��10-5 | 2��10-5 |
���ݱ��������ж�PM2.5�������Ϊ ��������pHֵ ��
��2��Ϊ����SO2���ŷţ�����ȡ�Ĵ�ʩ�У�
����úת��Ϊ�������ȼ�ϡ���֪��H2(g)+1/2O2(g)=H2O(g) ![]() H= -241.8KJ/mol
H= -241.8KJ/mol
C(s)+1/2O2(g)=CO(g) ![]() H= -110.5KJ/mol
H= -110.5KJ/mol
д����̿��ˮ������Ӧ���Ȼ�ѧ����ʽ ��
��ϴ�Ӻ�SO2���������������ʿ���ϴ�Ӽ����� ��
a��Ca(OH)2 b��Na2CO3 c��CaCl2 d��NaHSO3
��3������β����NOx��CO�����ɼ�ת��Ϊ��
����֪����������NO�ķ�ӦΪ��N2(g)+O2(g) ![]() 2NO(g)
2NO(g) ![]() H��0
H��0
��1mol��������0.8molN2��0.2molO2,1300��ʱ���ܱ������ڷ�Ӧ�ﵽƽ�⡣���NOΪ8��10-4mol.������¶��µ�ƽ�ⳣ��K= ___________�����������������¶�Խ�ߣ���λʱ����NO�ŷ���Խ��ԭ���� ��
������ȼ�Ͳ���ȫȼ��ʱ����CO���������밴���з�Ӧ��ȥCO��
2CO(g)=2C(s)+O2(g)��֪�÷�Ӧ��![]() H��0�������������ܷ�ʵ�ֵ����� ��
H��0�������������ܷ�ʵ�ֵ����� ��
��Ŀǰ��������β��ϵͳ��װ�ô�ת�����ɼ���CO��NO����Ⱦ���仯ѧ��Ӧ����ʽΪ ��
����Ŀ��������X������(��ͨ��)Y��Һ�����ɳ������������Y�����ʵ�����ϵ��ͼ��ʾ���±��з���ͼʾ�������

A | B | C | D | |
X | CO2 | HCl | NaOH | AlCl3 |
Y | Ca(OH)2 | NaAlO2 | AlCl3 | NaOH |
A.AB.BC.CD.D